
Atomet - Elektroner, skaller og orbitaler
Grundliggende kemi
Elektronerne
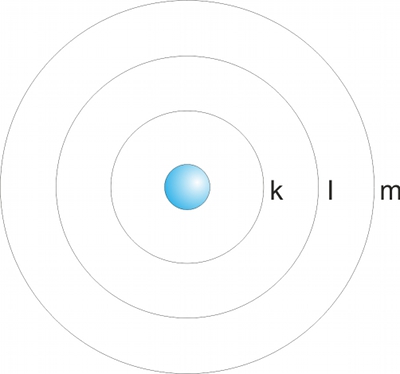
Fig. 1: Bohrmodellen for atomer med kernen i midten og elektroner der bevæger sig omkring kernen i skallerne k, l, m, osv.
Den korrekte beskrivelse af hvorledes elektronerne bevæger rundt om kernen hedder orbitaler. Der er grundliggende 4 typer orbitaler: s, p, d, og f. Hver orbital har sin egen arkitektur og egne egenskaber. Af historiske grunde bruger vi begrebet skaller og kalder dem k, l, m, etc. som ved Bohrmodellen. De er blot ikke skaller som i Bohrmodellen, hvilket kan give noget forvirring. Her er skallerne grupper af orbitaler.
Skallerne, dvs. grupperne af orbitaler, representerer også energiniveauer. De inderste elektroner/orbitaler har det laveste energiniveau, og er stærkest bundet til kernen. Bindingsenergien falder med stigende afstand til kernen. Atomerne tilstræber at have det lavest mulige energiniveau, så derfor bliver elektronerne fyldt på fra k-skallen og ud efter, dvs. først fyldes k-skallen, så l, m, n osv. I praksis fungerer det ikke helt så simpelt, så f.eks. dele af n-skallen fyldes op før m-skallen er helt fyldt op. Dette er et af de steder hvor vores modeller har nogle svagheder i forhold til at beskrive virkeligheden. Hvordan og hvorfor det hænger sådan sammen, kommer lidt længere nede.
Elektronerne i den yderste skal hedder også valenselektronerne.
Hvorfor er dette vigtigt?
- Tilstedeværelsen af orbitaler kan forklare, hvorfor det periodiske system ser ud som det gør.
- De forskellige orbitaler kan også forklare, hvorfor nogle bindinger mellem visse atomer er stærkere end andre.
- De kemiske egenskaber er et direkte resultat af orbitalerne. Så, mange af de ting der foregår i kemi vil give meget mere meget mere mening, når vi kommer til dem senere.
Lad os se nærmere på skaller og orbitaler.
s-orbitaler er sfæriske (figur 2 kommer). De er det nærmeste vi kommer til skallerne i Bohrmodellen. En s-orbital kan indeholde 2 elektroner.
k-skallen består af én s-orbital, hvilket er grunden til, at der kun kan være 2 elektroner i k-skallen.
p-orbitaler består af 3 identiske orbitaler. Hver af disse ligner 2 dråber der står spids mod spids, og de tre orbitaler står vinkelret på hinanden (figur 3 kommer). Arkitekturen betyder, at de har en positiv og en negativ ende. Hver af de tre p-orbitaler kan indeholde 2 elektroner, så p-orbitalen kan indeholde i alt 6 elektroner. For at skelne de tre p-orbitaler fra hinanden kaldes de px, py and pz, som reference til deres orientering i et koordinatsystem. Dette er i reglen kun noget man bruger, når man skal regne på orbitalerne. Til almindelig praktisk kemi, arbejder vi blot med at én p-orbital består af 3 orbitaler og op til 6 elektroner.
l-skallen består af én s- og én p-orbital, hvilket er grunden til, at der kan være 8 elektroner i skallen. Gassen neon (grundstof nr. 10) har således 10 elektroner der bevæger sig rundt, 2 elektroner i k-skallen (en s-orbital) og 8 i l-skallen (en s-orbital med 2 elektroner og en en p-orbital med 6 elektroner).
d-orbitaler består af 5 orbitaler, som hver indeholder 2 elektroner. Orbitalernes arkitektur er som vist i fig. 4 (figur kommer), og selv om de måske ser lidt underlige ud, er det ikke det som gør d-orbitaler interessante. Vi kommer tilbage til d-orbitalerne, når vi skal se på det periodiske system og dannelsen af ioner. d-orbitalerne er vigtige, da de er det der får gruppen af grundstoffer, der kaldes overgangsmetaller, til at opføre sig som de gør.
m-skallen består af én s-, én p- og én d-orbital, hvilket er grunden til, at der kan være 18 elektroner i skallen. Ved m-skallen er det, at vores normale regel for opfyldning af skallerne med elektroner går galt. d-orbitalerne i m-skallen har højere energiniveau end s-orbitalen i n-skallen, så derfor sker der det, at s- og p-orbitalerne i m-skallen fyldes først. Det er frem til grundstoffet argon. Herefter fyldes s-orbitalen i n-skallen, det er grundstofferne kalium og calcium, og først herefter, ved scandium, fyldes d-orbitalerne i m-skallen.
f-orbitaler består af 7 orbitaler, hver med plads til 2 elektroner. Arkitekturen af orbitalerne kan ses på fig. 5 (figur kommer). Som det ses, er orbitalerne forskellige fra de andre orbitaler. f-orbitalerne er dem der giver de sjældne jordarter, lantinider og actinider deres kemiske egenskaber.
Ud over s-, p-, d- og f-orbitalerne er det således, at i den yderste skal kan s- og p-orbitalerne danne hybridorbitaler, hvis forholdene er favorable. Orbitalerne hedder sp-, sp2- og sp3-orbitaler, afhængig af om det er en s-orbital der er blandet med hhv. 1, 2 eller 3 p-orbitaler. Hybridorbitalerne kan ses på fig. 6 (figuren kommer):
Som det ses, reflekterer hybridorbitalernes arkitektur blandingsforholdet. Som de originale orbitaler, kan hybriderne hver indeholde 2 elektroner. Hybridorbitalerne ses især ved carbon, silicium og germanium, og er bl.a. årsagen til at den organiske kemi er, som den er.
Som nogen måske har lagt mærket til, allerede nu, optræder elektronerne altid enten alene eller i par i orbitalerne. Disse refereres til som enten uparrede eller parrede elektroner. Et elektronpar i den ydre skal kaldes et lone pair.
Elektronen der bevæger sig rundt om kernen drejer om sin egen akse, hvilket gør den en lille smule magnetisk. Dette kaldes elektronens spin. En elektron hvor orienteringen af spin er irrelevant skrives som e−, mens elektroner med et spin skrives som ↑e−, eller blot ↑, ved spin op (spinkvantetallet mS = +½), og tilsvarende ↓e−, eller blot ↓, ved spin ned (spinkvantetallet mS = -½). Spinkvantetal og Paulis eksklusionsprincip, som det hører under, bliver gennemgået i et andet kapitel. To elektroner i en orbital vil opføre sig som almindelige magneter og parre nordpol med sydpol. Når man taler om elektroner i elektronpar, siger man at de har modsatrettet spin, hvilket sædvanligvis skrives sådan: ↑↓.
Kan der så være mere end 2 elektroner i en orbital? Nej, det kan der ikke. Iflg. Paulis eksklusionsprincip tillades der kun én elektron for hver kvantetilstand, og der er kun de to kvantetilstande +½ og -½ for elektroner.
Elektronerne fyldes i orbitalerne fra det laveste energiniveau og opefter. Hvis der er flere orbitaler med samme energiniveau, som det ses i p-, d-, og f-orbitalerne, er tommefingerreglen at der først tilføjes én elektron til hver af orbitalerne. Den anden elektron, til at danne et elektronpar, tilføres ikke før alle orbitaler med samme energiniveau har en elektron. Reglen om at elektroner fyldes i orbitaler med samme energiniveau, en ad gangen, og først danner elektronpar, når der ikke er flere ufyldte orbitaler, hedder Hunds regel (efter den tyske fysiker Friedrich Hermann Hund). Det er vigtigt at understrege, at det kun er en generel regel. Undtagelser er almindeligt forekommende. Den måde elektronerne er arrangeret på i orbitalerne på hedder elektronkonfigurationen, og skrives som orbital + antallet af elektroner som højtstillet skrift, så f.eks. 2 elektroner i første s-orbital vil hedde 1s2 og i anden s-orbital 2s2. Den eneste måde at få det til at give mening, er ved at se på nogle eksempler. De kommer i næste afsnit.
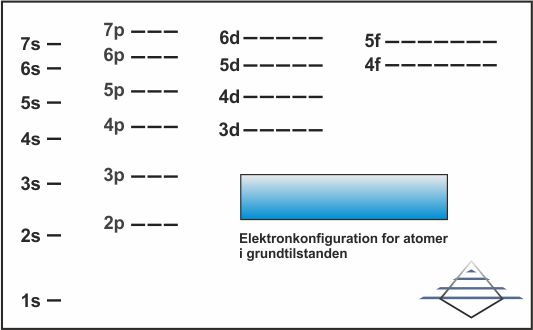 |
| Fig. 7: Relative energiniveauer for orbitaler (klik for at forstørre). |
Elektronkonfigurationen i grundtilstanden
Den simpleste måde at arbejde med elektronkonfigurationer på er i grundtilstanden, dvs. atomet når det ikke er påvirket af noget. Hvis man starter fra bunden med grundstod nr. 1, hydrogen, som har én elektron som skal placeres i den første orbital 1s (fig. 8). Elektronkonfigurationen er 1s1. Det andet grundstof, helium, har 2 elektroner. Med kun én elektron i 1s, er elektronerne nødt til at blive parret (fig. 9) og elektronkonfigurationen bliver 1s2.
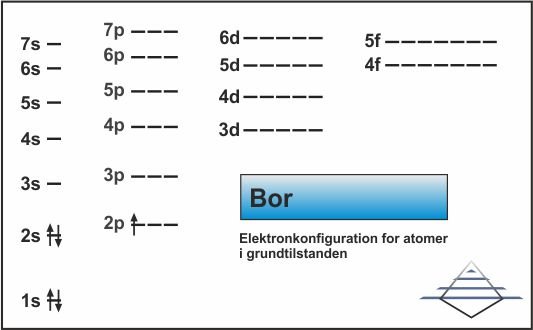
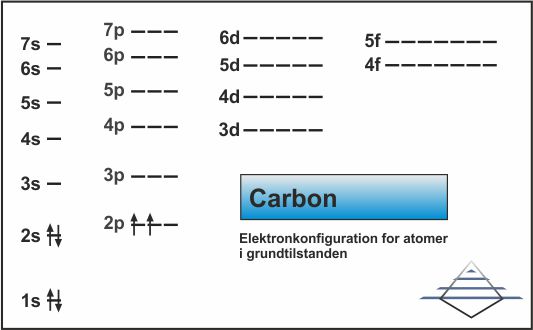
Grundstofferne 3 og 4 fylder op i 2s-orbitalen, og grundstof nr. 5, bor, begynder at bruge 2p-orbitalen (fig. 10). Elektronkonfigurationen for bor er 1s22s22p1. Det næste grundstof, carbon, har ikke 3 elektronpar yderst, men begynder at fylde de andre orbitaler med enkeltelektroner (fig. 11) og ved grundstof nr. 8, oxygen, begynder pardannelsen (fig. 12).
Som det kan ses, bliver elektronkonfugurationen en ret lang streng af bogstaver og tal, kalium ville blive skrevet som 1s22s22p63s23p1, så der laved en forkortet version ud fra den foregående ædelgas, skrevet i kantede paranteser, + elektronerne der er tilføjet efter denne. For kalium ser det således ud:[Ar]3p1.
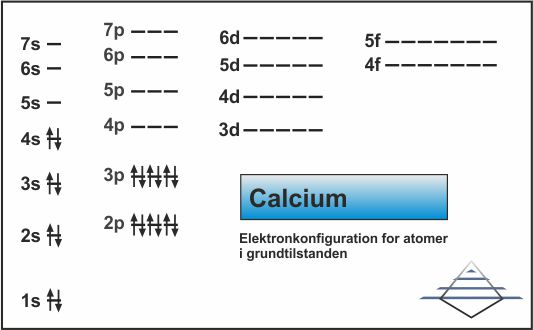
For de første tre perioder følger den rummelige opbygning af elektronerne og energien hinanden, indtil vi når d-orbitalerne. Som det ses i fig. 6, har 4s lavere energi end 3d. Så det der sker er, at 4s fyldes ud, hvilket giver calcium elektronkonfigurationen [Ar]4s2 (fig. 13), og det efterfølgende grundstof, scandium, vil så begynde at fylde på 3d-orbitalerne, og således have elektronkonfigurationen [Ar]3d14s2 (fig. 14). Bemærk at selv om 3d udfyldes efter 4s, skrives det før 4s dvs. den hierarkiske struktur på nummereringen har fortrinsret i forhold til den faktiske rækkefølge for tilføjelsen af elektroner.
Som tidligere nævnt, er der undtagelser for hvordan orbitalerne fyldes med elektroner. Iridium har den elektronkonfiguration man ville forvente: [Xe]4f145d76s2 (fig. 15). Platin burde så være [Xe]4f145d86s2 dvs. endnu en elektron i 5d-orbitalen, men det er den ikke. I stedet bliver elektronerne omarrangeret, idet en 6s elektron flyttes til 5d-orbitalen, så den faktiske elektronkonfiguration bliver [Xe]4f145d96s1 (fig. 16).
 |
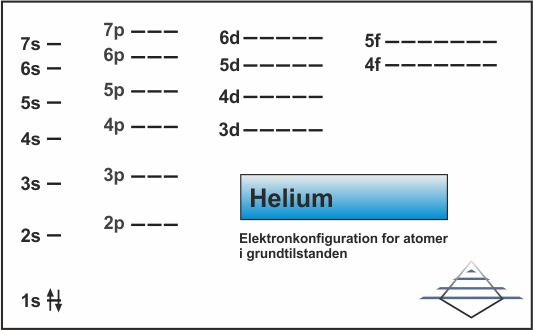 |
| Fig. 8: Elektronkonfiguration for hydrogen (klik for at forstørre) | Fig. 9: Elektronkonfiguration for helium (klik for at forstørre) |
Grundstofferne 3 og 4 fylder op i 2s-orbitalen, og grundstof nr. 5, bor, begynder at bruge 2p-orbitalen (fig. 10). Elektronkonfigurationen for bor er 1s22s22p1. Det næste grundstof, carbon, har ikke 3 elektronpar yderst, men begynder at fylde de andre orbitaler med enkeltelektroner (fig. 11) og ved grundstof nr. 8, oxygen, begynder pardannelsen (fig. 12).
 |
 |
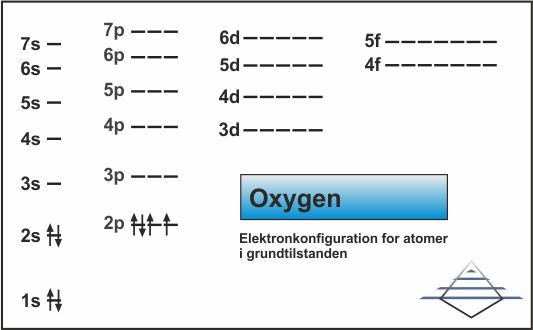 |
| Fig. 10: Elektronkonfiguration for bor (klik for at forstørre) | Fig. 11: Elektronkonfiguration for carbon (klik for at forstørre) | Fig. 12: Elektronkonfiguration for oxygen (klik for at forstørre) |
Som det kan ses, bliver elektronkonfugurationen en ret lang streng af bogstaver og tal, kalium ville blive skrevet som 1s22s22p63s23p1, så der laved en forkortet version ud fra den foregående ædelgas, skrevet i kantede paranteser, + elektronerne der er tilføjet efter denne. For kalium ser det således ud:[Ar]3p1.
For de første tre perioder følger den rummelige opbygning af elektronerne og energien hinanden, indtil vi når d-orbitalerne. Som det ses i fig. 6, har 4s lavere energi end 3d. Så det der sker er, at 4s fyldes ud, hvilket giver calcium elektronkonfigurationen [Ar]4s2 (fig. 13), og det efterfølgende grundstof, scandium, vil så begynde at fylde på 3d-orbitalerne, og således have elektronkonfigurationen [Ar]3d14s2 (fig. 14). Bemærk at selv om 3d udfyldes efter 4s, skrives det før 4s dvs. den hierarkiske struktur på nummereringen har fortrinsret i forhold til den faktiske rækkefølge for tilføjelsen af elektroner.
 |
 |
| Fig. 13: Elektronkonfiguration for calcium (klik for at forstørre) | Fig. 14: Elektronkonfiguration for scandium (klik for at forstørre) |
Som tidligere nævnt, er der undtagelser for hvordan orbitalerne fyldes med elektroner. Iridium har den elektronkonfiguration man ville forvente: [Xe]4f145d76s2 (fig. 15). Platin burde så være [Xe]4f145d86s2 dvs. endnu en elektron i 5d-orbitalen, men det er den ikke. I stedet bliver elektronerne omarrangeret, idet en 6s elektron flyttes til 5d-orbitalen, så den faktiske elektronkonfiguration bliver [Xe]4f145d96s1 (fig. 16).
 |
 |
| Fig. 15: Elektronkonfiguration for iridium (klik for at forstørre) | Fig. 16: Elektronkonfiguration for platin (klik for at forstørre) |
Elektronkonfigurationen udenfor grundtilstanden
De eneste grundstoffer der har en stabil elektronkonfiguration i grundtilstanden er ædelgasserne. De øvrige grundstoffer vil forsøge at arrangere de ydre skaller, eller i det mindste de ydre orbitaler, for at opnå den samme stabilitet. Dette gøres ved enten at optage eller afgive afgive elektroner eller omarrangere de medfødte elektroner. I visse tilfælde en kombination af at omarrangere og optage eller afgive elektroner. På samme måde som med elektronkonfigurationer i grundtilstanden, giver det kun mening, når man ser på eksempler fra den virkelige verden.
Hvis vi igen starter fra bunden med hydrogen, så har hydrogen én medfødt elektron. 1s orbitalen kræver 2 elektroner som et par, for at være stabil. Helium har to elektroner, hvilket er årsagen til at den er stabil, og helt ude af stand til at reagere med noget. For hydrogen er der to muligheder, afgive den ene elektron, så den ikke har en elektronkonfiguration, eller optage en, så elektronkonfigurationen bliver 1s2. I begge tilfælde ender hydrogen med en overskydende ladning, enten positiv, skrevet som H+, hvis den mister elektronen, eller H−, hvis den optager en elektron. Alternativet til at absorbere en elektron og blive negativt ladet, er dele elektronen med et andet hydrogen, så hvert hydrogen levere halvdelen til et elektronpar. Så bliver det til H2, og elektronparret bliver til det der hedder en kovalent binding, som binder de to hydrogenatomer sammen. Hvordan bindinger og orbitaler hænger sammen, bliver gennemgået i et andet kapitel.
Hvis vi går videre til grundstof nr. 3, lithium. Elektronkonfigurationen i grundtilstanden er 1s22s1. I modsætning til hydrogen, kan lithium ikke optage en elektron og blive til Li−, 1s22s2. I stedet vil det afgive 2s-elektronen og blive til Li+ med elektronkonfigurationen 1s2. På samme måde som hydrogen, kan lithium dele elektroner i par, f.eks. Li2, analogt til H2, og lithiumoxid Li2O, hvor de to lithiumatomer deler elektroner med oxygen, hvorved oxygen får opfyldt de to ufyldte 2p-orbitaler og de 2 lithium får fyldt deres egne 2s-orbitaler. Ved at være bundet til et grundstof, der er forskelligt fra sig selv, bliver bindingerne forskellige fra dem man ser ved H2 og Li2 (bliver nærmere forklaret under "Bindinger"), men det grundliggende princip med elektronparret er det samme.
I den anden ende af spektret er der et grundstof som chlor. Elektronkonfigurationen er [Ne]3s23p5. Mulighederne er at absorbere en elektron eller afgive mindst 5; 7 elektroner hvis vi skal nå elektronkonfigurationen for ædelgassen neon. For chlor og grundstofferne i den gruppe, er det at optage en elektron den letteste løsning. Chlor bliver således Cl−, med elektronkonfigurationen [Ne]3s23p6.
s- og p-orbitalerne er følsomme overfor uparrede elektroner og vil tilstræbe at få dem fjernet, men d- og f-orbitaler tolererer dem. I visse tilfælde er de uparrede elektroner det foretrukne. Jern kan eksistere som både Fe2+ og Fe3+. Elektronkonfigurationen i grundtilstanden er [Ar]3d64s2. Selvom d-elektronerne har den højeste energi, opnås Fe2+ i stedet ved at fjernes 4s-elektronerne (de yderste elektroner), så man får konfigurationen [Ar]3d6. I d-orbitalerne er dette 1 par og fire enkeltelektroner. Fe3+ som faktisk er den mest almindelige af de to ioner, har ydermere afgivet en d-elektron, hvilket giver konfigurationen [Ar]3d5 dvs. 5 uparrede elektroner i den ydre skal.
Man kunne foranlediges til at tro, at med 4 eller 5 uparrede elektroner i yderste skal, kan jern have 4 eller 5 kovalente bindinger, analogt til oxygens to uparrede elektroner der giver 2 kovalente bindinger og hydrogenets ene binding. Det kan den ikke! Jern er det der hedder et overgangsmetal, og de danner ikke kovalente bindinger. Jern kan danne ionbindinger og metalbindinger, som begge er fundamentalt forskellige fra kovalente bindinger. Forskellen, og hvordan det fungerer, bliver gennemgået under "Bindinger". Man kan i noget undervisningsmateriale støde på, at antallet af uparrede elektroner i yderste skal, er det sammen som antal bindinger. Det er noget vrøvl, der kommer af at man har forsøgt at dumme sammenhængen mellem elektroner og bindinger ned, så den passede med de hoved- og undergrupper man tidligere delte grundstofferne op i.
I stedet for at afgive, optage og flytte rundt på elektroner i orbitalerne, findes der en mulighed for hybridisering af orbitaler. Carbon har elektronkonfigurationen [He]2s22p2. Umiddelbart er mulighederne at afgive 2 eller 4 elektroner, eller absorbere 4 elektroner, og herved blive til C2+, C4+ eller C4−, men ingen af dem sker i virkeligheden. I stedet danner carbon kovalente bindinger med elektronerne. Det er muligt for carbon at danne 2 kovalente bindinger med orbitalerne i grundkonfigurationen, det er det der sker ved carbonmonooxid (CO), men det mest almindelige er imidlertid, at s- og p-orbitalerne fusionerer. De fire orbitaler, en s- og tre p-orbitaler, fusionerer til 4 sp3-orbitaler, hver med én uparret elektron. Elektronkonfigurationen er nu [He]2sp34. Muligheden for at have 2 eller 4 uparrede elektroner, er således årsagen til at carbon kan lave både 2 og 4 bindinger.
Hvis vi igen starter fra bunden med hydrogen, så har hydrogen én medfødt elektron. 1s orbitalen kræver 2 elektroner som et par, for at være stabil. Helium har to elektroner, hvilket er årsagen til at den er stabil, og helt ude af stand til at reagere med noget. For hydrogen er der to muligheder, afgive den ene elektron, så den ikke har en elektronkonfiguration, eller optage en, så elektronkonfigurationen bliver 1s2. I begge tilfælde ender hydrogen med en overskydende ladning, enten positiv, skrevet som H+, hvis den mister elektronen, eller H−, hvis den optager en elektron. Alternativet til at absorbere en elektron og blive negativt ladet, er dele elektronen med et andet hydrogen, så hvert hydrogen levere halvdelen til et elektronpar. Så bliver det til H2, og elektronparret bliver til det der hedder en kovalent binding, som binder de to hydrogenatomer sammen. Hvordan bindinger og orbitaler hænger sammen, bliver gennemgået i et andet kapitel.
Hvis vi går videre til grundstof nr. 3, lithium. Elektronkonfigurationen i grundtilstanden er 1s22s1. I modsætning til hydrogen, kan lithium ikke optage en elektron og blive til Li−, 1s22s2. I stedet vil det afgive 2s-elektronen og blive til Li+ med elektronkonfigurationen 1s2. På samme måde som hydrogen, kan lithium dele elektroner i par, f.eks. Li2, analogt til H2, og lithiumoxid Li2O, hvor de to lithiumatomer deler elektroner med oxygen, hvorved oxygen får opfyldt de to ufyldte 2p-orbitaler og de 2 lithium får fyldt deres egne 2s-orbitaler. Ved at være bundet til et grundstof, der er forskelligt fra sig selv, bliver bindingerne forskellige fra dem man ser ved H2 og Li2 (bliver nærmere forklaret under "Bindinger"), men det grundliggende princip med elektronparret er det samme.
I den anden ende af spektret er der et grundstof som chlor. Elektronkonfigurationen er [Ne]3s23p5. Mulighederne er at absorbere en elektron eller afgive mindst 5; 7 elektroner hvis vi skal nå elektronkonfigurationen for ædelgassen neon. For chlor og grundstofferne i den gruppe, er det at optage en elektron den letteste løsning. Chlor bliver således Cl−, med elektronkonfigurationen [Ne]3s23p6.
s- og p-orbitalerne er følsomme overfor uparrede elektroner og vil tilstræbe at få dem fjernet, men d- og f-orbitaler tolererer dem. I visse tilfælde er de uparrede elektroner det foretrukne. Jern kan eksistere som både Fe2+ og Fe3+. Elektronkonfigurationen i grundtilstanden er [Ar]3d64s2. Selvom d-elektronerne har den højeste energi, opnås Fe2+ i stedet ved at fjernes 4s-elektronerne (de yderste elektroner), så man får konfigurationen [Ar]3d6. I d-orbitalerne er dette 1 par og fire enkeltelektroner. Fe3+ som faktisk er den mest almindelige af de to ioner, har ydermere afgivet en d-elektron, hvilket giver konfigurationen [Ar]3d5 dvs. 5 uparrede elektroner i den ydre skal.
Man kunne foranlediges til at tro, at med 4 eller 5 uparrede elektroner i yderste skal, kan jern have 4 eller 5 kovalente bindinger, analogt til oxygens to uparrede elektroner der giver 2 kovalente bindinger og hydrogenets ene binding. Det kan den ikke! Jern er det der hedder et overgangsmetal, og de danner ikke kovalente bindinger. Jern kan danne ionbindinger og metalbindinger, som begge er fundamentalt forskellige fra kovalente bindinger. Forskellen, og hvordan det fungerer, bliver gennemgået under "Bindinger". Man kan i noget undervisningsmateriale støde på, at antallet af uparrede elektroner i yderste skal, er det sammen som antal bindinger. Det er noget vrøvl, der kommer af at man har forsøgt at dumme sammenhængen mellem elektroner og bindinger ned, så den passede med de hoved- og undergrupper man tidligere delte grundstofferne op i.
I stedet for at afgive, optage og flytte rundt på elektroner i orbitalerne, findes der en mulighed for hybridisering af orbitaler. Carbon har elektronkonfigurationen [He]2s22p2. Umiddelbart er mulighederne at afgive 2 eller 4 elektroner, eller absorbere 4 elektroner, og herved blive til C2+, C4+ eller C4−, men ingen af dem sker i virkeligheden. I stedet danner carbon kovalente bindinger med elektronerne. Det er muligt for carbon at danne 2 kovalente bindinger med orbitalerne i grundkonfigurationen, det er det der sker ved carbonmonooxid (CO), men det mest almindelige er imidlertid, at s- og p-orbitalerne fusionerer. De fire orbitaler, en s- og tre p-orbitaler, fusionerer til 4 sp3-orbitaler, hver med én uparret elektron. Elektronkonfigurationen er nu [He]2sp34. Muligheden for at have 2 eller 4 uparrede elektroner, er således årsagen til at carbon kan lave både 2 og 4 bindinger.