
At skrive kemi
Atomer og molekyler/kemiske forbindelser
Når man skal skrive kemi, er det vigtigt at huske, at syntaksen er informationsbærende. Det betyder, at der er forskel på om man bruger store eller små bogstaver, om man har højtstillet eller lavtstillet skrift, osv.
Der er således forskel på om man skriver CO eller Co. CO er den kemiske forbindelse carbonmonooxid, mens Co er metallet cobolt. Ligeledes er der forskel på om man skriver 2 H, 2H eller H2. 2 H er to hydrogenatomer der ikke hænger sammen, 2H er hydrogenisotopen deuterium, mens H2 er 2 hydrogenatomer der er forbundet med en kovalent binding til ét molekyle.
Så, måden man skriver antallet af atomer eller kemiske forbindelser på, er at foranstillede tal, f.eks. 2 H, refererer til et antal separate enheder, mens de bagvedstillede tal, med lavtstillet skrift, f.eks. H2, refererer til antallet af atomer/kemiske forbindelser i den samme kemiske forbindelse. Det betyder, at hvis man f.eks. ser 2 H2, så er der 2 hydrogenmolekyler, som hver består af 2 hydrogenatomer, dvs. man har 4 hydrogenatomer i alt.
Når man skal skive ladninger på ioner og komplekser, skrives dette med højtstillet skrift. Hvis vi tager de simple ioner med kun en enkelt ladning, er det f.eks. H+ og OH−. Har ionerne/komplekserne flere ladninger, skrives antallet foran ladningen, f.eks. SO42− og Fe3+. Man kan støde på gammel litteratur , hvor man skriver ladningerne ud, f.eks. Fe++, men på samme måde som vi ikke siger elefant elefant, men to elefanter, skriver vi i dag Fe2+.
Man kan, ude i den virkelige verden, støde på alternative skrivemåder som f.eks. CO2 og H2O. Dette er ikke en korrekt skrivemåde, og har aldrig været det.
Der er således forskel på om man skriver CO eller Co. CO er den kemiske forbindelse carbonmonooxid, mens Co er metallet cobolt. Ligeledes er der forskel på om man skriver 2 H, 2H eller H2. 2 H er to hydrogenatomer der ikke hænger sammen, 2H er hydrogenisotopen deuterium, mens H2 er 2 hydrogenatomer der er forbundet med en kovalent binding til ét molekyle.
Så, måden man skriver antallet af atomer eller kemiske forbindelser på, er at foranstillede tal, f.eks. 2 H, refererer til et antal separate enheder, mens de bagvedstillede tal, med lavtstillet skrift, f.eks. H2, refererer til antallet af atomer/kemiske forbindelser i den samme kemiske forbindelse. Det betyder, at hvis man f.eks. ser 2 H2, så er der 2 hydrogenmolekyler, som hver består af 2 hydrogenatomer, dvs. man har 4 hydrogenatomer i alt.
Når man skal skive ladninger på ioner og komplekser, skrives dette med højtstillet skrift. Hvis vi tager de simple ioner med kun en enkelt ladning, er det f.eks. H+ og OH−. Har ionerne/komplekserne flere ladninger, skrives antallet foran ladningen, f.eks. SO42− og Fe3+. Man kan støde på gammel litteratur , hvor man skriver ladningerne ud, f.eks. Fe++, men på samme måde som vi ikke siger elefant elefant, men to elefanter, skriver vi i dag Fe2+.
Man kan, ude i den virkelige verden, støde på alternative skrivemåder som f.eks. CO2 og H2O. Dette er ikke en korrekt skrivemåde, og har aldrig været det.
Kemiske formler
Formler er en måde at skrive forholdstallene på, for en kemisk forbindelse. Man arbejder med tre typer af formler:
Empirisk formel er forholdstallene for atomerne skåret helt ned til det mindste. Man har med den empiriske formel ingen strukturelle oplysninger om den kemiske forbindelse, så hvis man har den empiriske formel CH, ved man blot at forholdet C:H er 1:1, men om der er tale om benzen (C6H6) eller acetylen (C2H2), eller noget helt tredie, har man ingen mulighed for at se ud fra formlen.
Sumformlen er det som de fleste forbinder med kemiske formler, og indeholder en del strukturelle oplysninger om den kemiske forbindelse. Det at skrive sumformler, giver plads til lidt kreativitet, i forhold til at få så mange strukturelle data med, som muligt, så måden at skrive sumformler på, er ikke helt entydig.
Hvis vi starter med de uorganiske forbindelser, så har man en del veldefinerede ioner, og man har en form for konsensus for rækkefølgen hvormed man nævner dem. De positivt ladede ioner skrives først, og de sammensatte ioner skrives samlet, f.eks. sulfationen SO42− i calciumsulfat, CaSO4, i stedet for blot at liste atomerne alfabetisk som CaO4S. Man kan godt have flere af samme veldefinerede ion, som man har i hydroxyapatit Ca5(PO4)3OH, som indeholder tre phosphationer, PO43−. Er der mere end den ene, sætter man en parantes om den sammensatte ion og efter parantesen skriver man så hvor mange der er af ionen. Er der flere f.eks. negativt ladede ioner, som i hydroxyapatitten, har man en historisk betinget rækkefølge, dvs. sådan har vi altid gjort, og i mangel på en tradition, listes de alfabetisk.
I visse dele af undervisningssystemet lærer man, at forholdstallene altid skal være heltal. Men, i den virkelige verden bruger man decimaltal. Det er noget der anvendes, både ved naturlige mineraler og ved dopede krystaller til højteknologisk udstyr. Et mineral som dolomit er CaCO3 hvor Ca er delvis udskiftet med Mg i krystalstrukturen. Hvis man ikke kender forholdet mellem Ca og Mg, skriver det gerne som (Ca·Mg)CO3 eller CaMg(CO3)2. Man kunne her forledes til at tro, at forholdet Ca:Mg så er 1:1, men, i den almindeligt forekommende dolomit er formlen ca. Ca0,62Mg0,38CO3. Der er referencer til, at man også kan finde kvaliteter hvor forholdet mellem Ca og Mg ligger omkring 1:1, men det er ikke normalen. Så, hvis man kender forholdstallet for substitutionerne i krystalstrukturen, skriver man det som decimaltal, som vist for dolomitten.
De organiske forbindelser bliver hurtigt så store, at man ikke kan lave en sumformel der viser strukturen, hvis man kender den. I så fald nøjes man med at vise så meget af strukturen, som det lader sig gøre. Det går let nok for de små molekyler, f.eks. ethanol: CH3CH2OH, men allerede ved propanol melder udfordringerne sig. Hvis man nøjes med at skrive sumformlen C3H8O, kender man blandingforholdet for atomerne, og man kender molvægten, men vi kan ikke se, om det er propanol eller methyl-ethyl-ether. Hvis vi siger, at vi ved det er propanol, men ikke ved om det er 1-propanol eller 2-propanol, vil man skrive C3H7OH. Hvis vi ved hvilken af de to typer propanol det drejer sig om, er sumformlerne hhv. CH3CH2CH2OH og CH3CH(OH)CH3.
Så derfor: sumformlen afspejler den viden vi har om den kemiske forbindelses struktur, som det er praktisk muligt at skrive.
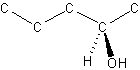
Strukturformlen er den formel vi har, der er mest beskrivende for en kemisk forbindelses struktur. Hvis vi har et molekyle som pentanol, så er formlen C5H11OH, men vi ved ikke hvilken position OH-gruppen sidder på. Men det kan vi vise med strukturformlen (hydrogen på C er ikke vist):

Faktisk kan vi, hvis vi tegner lidt bedre, også vise en rummelig struktur, hvor dette er relevant for forståelsen af strukturformlen:
- empirisk formel
- sumformel (også kaldet kemisk formel, bruttoformel eller molekylformel)
- strukturformel
Empirisk formel er forholdstallene for atomerne skåret helt ned til det mindste. Man har med den empiriske formel ingen strukturelle oplysninger om den kemiske forbindelse, så hvis man har den empiriske formel CH, ved man blot at forholdet C:H er 1:1, men om der er tale om benzen (C6H6) eller acetylen (C2H2), eller noget helt tredie, har man ingen mulighed for at se ud fra formlen.
Sumformlen er det som de fleste forbinder med kemiske formler, og indeholder en del strukturelle oplysninger om den kemiske forbindelse. Det at skrive sumformler, giver plads til lidt kreativitet, i forhold til at få så mange strukturelle data med, som muligt, så måden at skrive sumformler på, er ikke helt entydig.
Hvis vi starter med de uorganiske forbindelser, så har man en del veldefinerede ioner, og man har en form for konsensus for rækkefølgen hvormed man nævner dem. De positivt ladede ioner skrives først, og de sammensatte ioner skrives samlet, f.eks. sulfationen SO42− i calciumsulfat, CaSO4, i stedet for blot at liste atomerne alfabetisk som CaO4S. Man kan godt have flere af samme veldefinerede ion, som man har i hydroxyapatit Ca5(PO4)3OH, som indeholder tre phosphationer, PO43−. Er der mere end den ene, sætter man en parantes om den sammensatte ion og efter parantesen skriver man så hvor mange der er af ionen. Er der flere f.eks. negativt ladede ioner, som i hydroxyapatitten, har man en historisk betinget rækkefølge, dvs. sådan har vi altid gjort, og i mangel på en tradition, listes de alfabetisk.
I visse dele af undervisningssystemet lærer man, at forholdstallene altid skal være heltal. Men, i den virkelige verden bruger man decimaltal. Det er noget der anvendes, både ved naturlige mineraler og ved dopede krystaller til højteknologisk udstyr. Et mineral som dolomit er CaCO3 hvor Ca er delvis udskiftet med Mg i krystalstrukturen. Hvis man ikke kender forholdet mellem Ca og Mg, skriver det gerne som (Ca·Mg)CO3 eller CaMg(CO3)2. Man kunne her forledes til at tro, at forholdet Ca:Mg så er 1:1, men, i den almindeligt forekommende dolomit er formlen ca. Ca0,62Mg0,38CO3. Der er referencer til, at man også kan finde kvaliteter hvor forholdet mellem Ca og Mg ligger omkring 1:1, men det er ikke normalen. Så, hvis man kender forholdstallet for substitutionerne i krystalstrukturen, skriver man det som decimaltal, som vist for dolomitten.
De organiske forbindelser bliver hurtigt så store, at man ikke kan lave en sumformel der viser strukturen, hvis man kender den. I så fald nøjes man med at vise så meget af strukturen, som det lader sig gøre. Det går let nok for de små molekyler, f.eks. ethanol: CH3CH2OH, men allerede ved propanol melder udfordringerne sig. Hvis man nøjes med at skrive sumformlen C3H8O, kender man blandingforholdet for atomerne, og man kender molvægten, men vi kan ikke se, om det er propanol eller methyl-ethyl-ether. Hvis vi siger, at vi ved det er propanol, men ikke ved om det er 1-propanol eller 2-propanol, vil man skrive C3H7OH. Hvis vi ved hvilken af de to typer propanol det drejer sig om, er sumformlerne hhv. CH3CH2CH2OH og CH3CH(OH)CH3.
Så derfor: sumformlen afspejler den viden vi har om den kemiske forbindelses struktur, som det er praktisk muligt at skrive.
Strukturformlen er den formel vi har, der er mest beskrivende for en kemisk forbindelses struktur. Hvis vi har et molekyle som pentanol, så er formlen C5H11OH, men vi ved ikke hvilken position OH-gruppen sidder på. Men det kan vi vise med strukturformlen (hydrogen på C er ikke vist):

Faktisk kan vi, hvis vi tegner lidt bedre, også vise en rummelig struktur, hvor dette er relevant for forståelsen af strukturformlen:

Reaktionsligninger
Hvordan man skriver reaktionsligninger, afhænger i nogen grad af reaktionstypen. Der er nogle generelle regler, som vi gennemgår her, men ellers fremgår det af de forskellige afsnit på denne hjemmeside.
En reaktionsligning viser reaktioner, eller mangel på samme.
Den traditionelle måde at vise en reaktion på er reaktanter på venstre side af en reaktionspil og produkter på højre side af reaktionspilen. Sådan her:
A + B C + D
C + D
Fordi vi læser fra venstre til højre, læser og skriver vi også helst reaktionsligninger på den måde, men der er som sådan ikke noget i vejen for at skrive fra højre mod venstre, på denne måde:
D + C B + A
B + A
Det kan også være, at der ikke sker noget. Ingen reaktion er lige så vigtig, som at der sker en reaktion. Dette skriver man således:
A + B
Der er ikke ladninger eller atomer der dukker op eller forsvinder under reaktionen.
Reaktioner skal være afstemt, så der er det samme antal af de forskellige atomer, på begge sider af reaktionspilen. Der må ikke være atomer der forsvinder, eller dukker på, f.eks. hvis der kun var en enkelt Ag+ på venstre side af denne ligning:
Cu + 2 Ag+ 2 Ag + Cu2+
2 Ag + Cu2+
Det samme med ladinger. Samme totalladning (+2 i det viste eksempel) på begge sider af reaktionspilen, ellers er reaktionen ikke afstemt korrekt. Der er ikke atomer eller ladninger der dukker op eller forsvinder.
Forholdstallene behøver ikke at være heltal.
Til reaktionsligninger kan man godt lide at forholdstallene er heltal, og i visse undervisningsinstitutioner betragtes det som den eneste rigtige måde at aflevere et resultat på. Men, selv om det må betragtes som god stil at have heltal, fordi det gør det lettere at læse reaktionsligningerne, så er det ikke et formelt krav i forhold til kemi. Så en reaktion, afstemt som dette
H2 + ½ O2 H2O
H2O
er fuldt acceptabel, så længe forholdstallene er korrekte.
En reaktionsligning viser reaktioner, eller mangel på samme.
Den traditionelle måde at vise en reaktion på er reaktanter på venstre side af en reaktionspil og produkter på højre side af reaktionspilen. Sådan her:
A + B
 C + D
C + DFordi vi læser fra venstre til højre, læser og skriver vi også helst reaktionsligninger på den måde, men der er som sådan ikke noget i vejen for at skrive fra højre mod venstre, på denne måde:
D + C
 B + A
B + ADet kan også være, at der ikke sker noget. Ingen reaktion er lige så vigtig, som at der sker en reaktion. Dette skriver man således:
A + B

Der er ikke ladninger eller atomer der dukker op eller forsvinder under reaktionen.
Reaktioner skal være afstemt, så der er det samme antal af de forskellige atomer, på begge sider af reaktionspilen. Der må ikke være atomer der forsvinder, eller dukker på, f.eks. hvis der kun var en enkelt Ag+ på venstre side af denne ligning:
Cu + 2 Ag+
 2 Ag + Cu2+
2 Ag + Cu2+Det samme med ladinger. Samme totalladning (+2 i det viste eksempel) på begge sider af reaktionspilen, ellers er reaktionen ikke afstemt korrekt. Der er ikke atomer eller ladninger der dukker op eller forsvinder.
Forholdstallene behøver ikke at være heltal.
Til reaktionsligninger kan man godt lide at forholdstallene er heltal, og i visse undervisningsinstitutioner betragtes det som den eneste rigtige måde at aflevere et resultat på. Men, selv om det må betragtes som god stil at have heltal, fordi det gør det lettere at læse reaktionsligningerne, så er det ikke et formelt krav i forhold til kemi. Så en reaktion, afstemt som dette
H2 + ½ O2
 H2O
H2Oer fuldt acceptabel, så længe forholdstallene er korrekte.
Tilstandsformer
I den klassiske kemi til undervisningsbrug, opererer man med fire tilstandsformer til reaktionsligninger:
Ag+(aq) + Cl−(aq) AgCl(s)
AgCl(s)
Dette er IKKE de eneste tilstandsformer man kan have. Man kan en sjælden gang se tilstandsformen (cr) anvendt ved krystallinsk bundfald, men tilstandsformer som plasma og superkritisk har man ikke en notation for. Ligeledes foregår meget organisk kemi i en række organiske solventer, men modsat de vandige opløsninger, har man ikke en notation for organisk opløsning, eller for den sags skyld en uorganisk opløsning, som man kender det fra hydrogeneringer med f.eks. en palladiumkatalysator, hvor H2 er opløst i metallet.
Hvis man har reaktioner med tilstandsformer, som ikke er dækket af de fire tilstandsformer (s), (l), (g) og (aq), skal det blot fremgå af den medfølgende tekst til reaktionsligningen.
- s: solid, dvs. fast stof
- l: liquid, dvs. flydende
- g: gas, dvs. på gasform
- aq: aqueous solution, dvs. i vandig opløsning
Ag+(aq) + Cl−(aq)
 AgCl(s)
AgCl(s)Dette er IKKE de eneste tilstandsformer man kan have. Man kan en sjælden gang se tilstandsformen (cr) anvendt ved krystallinsk bundfald, men tilstandsformer som plasma og superkritisk har man ikke en notation for. Ligeledes foregår meget organisk kemi i en række organiske solventer, men modsat de vandige opløsninger, har man ikke en notation for organisk opløsning, eller for den sags skyld en uorganisk opløsning, som man kender det fra hydrogeneringer med f.eks. en palladiumkatalysator, hvor H2 er opløst i metallet.
Hvis man har reaktioner med tilstandsformer, som ikke er dækket af de fire tilstandsformer (s), (l), (g) og (aq), skal det blot fremgå af den medfølgende tekst til reaktionsligningen.