
Opløsninger med ioner
Konduktivitet
Indledning
For at en opløsning kan lede en strøm, skal den indeholde ioner. I den klassiske kemi kræver dette kemiske forbindelser der dissocierer i vand, og det er også den type ledende opløsninger som dette kapitel omhandler.
Kemiske forbindelser, der ved opvarmning, smeltning og/eller opløsning kan lede en elektriske strøm kaldes elektrolytter. Ledningsevnen er afhængig af koncentrationen af ionerne, hvilket for syrer og baser hænger sammen med dissociationsgraden, α. Man skelner derfor mellem stærke elektrolytter, dem er dissocierer helt, og svage elektrolytter, dem der dissocierer delvist.
Til undervisningsbrug er man vandt til at tænke på vand, og kun vand, som solvent, fordi vand normalt er en forudsætning for iondannelse. I praksis, behøver solventet ikke at være rent vand, og til mange produkter er det helt almindeligt at have andre væsker iblandet, f.eks. ethanol. Så derfor er vandige opløsninger af elektrolytter ikke det samme som at solventet kun er vand.
Man har fået en klasse af molekyler der hedder ioniske væsker, som kan give anledning til misforståelser. Ioniske væsker er molekyler med en ladning, uden at være dissocieret og uden tilstedeværelsen af vand. Selv om der er tale om ioner, er disse at sammenligne med andre ledende materialer, og skal i forhold til ledningsevne regnes på som en almindelig elektrisk leder som f.eks. kobber eller en carbonfyldt plast.
Kemiske forbindelser, der ved opvarmning, smeltning og/eller opløsning kan lede en elektriske strøm kaldes elektrolytter. Ledningsevnen er afhængig af koncentrationen af ionerne, hvilket for syrer og baser hænger sammen med dissociationsgraden, α. Man skelner derfor mellem stærke elektrolytter, dem er dissocierer helt, og svage elektrolytter, dem der dissocierer delvist.
Til undervisningsbrug er man vandt til at tænke på vand, og kun vand, som solvent, fordi vand normalt er en forudsætning for iondannelse. I praksis, behøver solventet ikke at være rent vand, og til mange produkter er det helt almindeligt at have andre væsker iblandet, f.eks. ethanol. Så derfor er vandige opløsninger af elektrolytter ikke det samme som at solventet kun er vand.
Man har fået en klasse af molekyler der hedder ioniske væsker, som kan give anledning til misforståelser. Ioniske væsker er molekyler med en ladning, uden at være dissocieret og uden tilstedeværelsen af vand. Selv om der er tale om ioner, er disse at sammenligne med andre ledende materialer, og skal i forhold til ledningsevne regnes på som en almindelig elektrisk leder som f.eks. kobber eller en carbonfyldt plast.
Modstand og konduktans for opløsninger
I vandige opløsninger er der en naturlig begrænsning i modstanden man kan opnå, idet vands autoprotolyse giver en koncentration af H+, reelt H3O+, og OH− på begge 10−7 M. Ved tilsætning af stærke elektrolytter, vil koncentrationen af ioner stige, og modstanden falde. Hvis man sender en strøm igennem opløsningen, vil den målte modstand være en funktion af afstanden mellem elektroderne, elektrodernes overfladeareal (vi forudsætter at elektroderne har samme overfladeareal) og typen af ioner.
Opløsningens konduktans er reciprokværdien af modstanden og benævnes S (eller L), dvs.
Enheden for konduktansen er siemens (S eller Ω−1). I ældre litteratur kan man for Ω−1 støde på navnet mho (ohm stavet bagfra).
Udtrykket for konduktansen, der tager højde for afstanden mellem elektroderne (d, nogle gange kaldet ℓ), elektrodernes overfladeareal (A), som er en funktion af det geometriske areal gange ruhedsfaktor, og konduktiviteten, κ, ser således ud:
Den elektriske konduktivitet for en opløsning af elektrolytter, κ, er summen af alle ioner i opløsningen. Summen i denne sammenhæng er alle egenskaber, dvs. type, koncentration, mobilitet osv.
Forholdet d/A er en konstant for en given måling, og kaldes for cellekonstanten, Kcelle eller θ. En opløsnings modstand er noget man bestemmer, f.eks. med en Wheatstone bro. Konduktiviteten er omvendt proportional med den målte resisitivitet i målecellen:
Cellekonstanten Kcelle er noget der bestemmes ved at måle cellens modstand i en opløsning med kendt ledningsevne. Man har en række opløsninger, hvor man kender ledningsevnen med stor nøjagtighed, som man anvender til dette. I praksis er dette nogle færdig opløsninger man køber til formålet.
Opløsningens konduktans er reciprokværdien af modstanden og benævnes S (eller L), dvs.
| S = | 1 |
| R |
Enheden for konduktansen er siemens (S eller Ω−1). I ældre litteratur kan man for Ω−1 støde på navnet mho (ohm stavet bagfra).
Udtrykket for konduktansen, der tager højde for afstanden mellem elektroderne (d, nogle gange kaldet ℓ), elektrodernes overfladeareal (A), som er en funktion af det geometriske areal gange ruhedsfaktor, og konduktiviteten, κ, ser således ud:
| S = κ · | A |
| d |
Den elektriske konduktivitet for en opløsning af elektrolytter, κ, er summen af alle ioner i opløsningen. Summen i denne sammenhæng er alle egenskaber, dvs. type, koncentration, mobilitet osv.
Forholdet d/A er en konstant for en given måling, og kaldes for cellekonstanten, Kcelle eller θ. En opløsnings modstand er noget man bestemmer, f.eks. med en Wheatstone bro. Konduktiviteten er omvendt proportional med den målte resisitivitet i målecellen:
| κ = | Kcelle | = S · Kcelle |
| R |
Cellekonstanten Kcelle er noget der bestemmes ved at måle cellens modstand i en opløsning med kendt ledningsevne. Man har en række opløsninger, hvor man kender ledningsevnen med stor nøjagtighed, som man anvender til dette. I praksis er dette nogle færdig opløsninger man køber til formålet.
Elektrisk mobilitet
Den elektriske mobilitet er de ladede ioners hastighed i opløsningen, når der løber en strøm gennem opløsningen. Mobiliteten er interessant af flere grunde: den elektriske mobilitet for en ion påvirker den elektriske ledningsevne, dvs. ledningsevnen for 1 M HCl er forskellig fra ledningsevnen for 1 M KCl, og ved batterier, især genopladelige batterier, har nedsat mobilitet en negativ effekt på batteriets kapacitet. Analysekemisk udnytter man forskellen i elektrisk mobilitet til separation af proteiner i gelelektroforese.
Den elektriske mobilitet, μ, for en ion er dens drivhastighed i det elektriske felts retning, divideret med den elektriske feltstyrke, E:
Ionernes bevægelse er ikke en ret linje mellem de to elektroder. Brownske bevægelser sender ionerne i tilfældige retninger, så drivhastigheden for ionerne er ikke ionernes egen hastighed, men den gennemsnitlige hastighed hvormed ionen flytter sig i det elektriske felts retning.
Mobiliteten er den del af ledningsevnen, som er uafhængig af koncentrationen. Under ideale forhold er mobiliteten af en given ion i:
Konduktiviteten kan udtrykkes ved mobiliteten som:
Den elektriske mobilitet, μ, for en ion er dens drivhastighed i det elektriske felts retning, divideret med den elektriske feltstyrke, E:
| μ = | dx/dt |
| E |
Ionernes bevægelse er ikke en ret linje mellem de to elektroder. Brownske bevægelser sender ionerne i tilfældige retninger, så drivhastigheden for ionerne er ikke ionernes egen hastighed, men den gennemsnitlige hastighed hvormed ionen flytter sig i det elektriske felts retning.
Mobiliteten er den del af ledningsevnen, som er uafhængig af koncentrationen. Under ideale forhold er mobiliteten af en given ion i:
| μi = | | zi | · e |
| 6 · π · η · Ri |
| zi | Ionens ladning |
| Ri | Ionens solvatisered radius |
| η | Solventets viskositet |
| e | Elementarladningen = 1,602176565(35) · 10-19 C |
Konduktiviteten kan udtrykkes ved mobiliteten som:
| κ | = | F ·
| ||||||
| = | F ·
| ( | | zi | · e | ) | · ci | |||
| 6 · π · η · Ri | ||||||||
Molar konduktivitet og Kohlrausch' lov
Fordi ledningsevnen er koncentrationsafhængig, har man, for at kunne sammenligne ionerne, den molare ledningsevne, Λ, som er konduktiviteten, κ, divideret med den samlede koncentration af ioner, C:
Under ideelle forhold burde man få den samme værdi for Λ for en elektrolyt, uanset koncentrationen man måler ved. Men, fordi ikke alle elektrolytter er stærke, og fordi ionerne påvirker hinanden i opløsningen, er dette ikke tilfældet. Man har derfor Λ0, som er den molære ledningsevne ved uendelig fortynding. Den uendelige fortynding, og praktiske i dette, kommer vil tilbage til længere nede.
Ved den ideale uendelige fortynding er en given elektrolyt fuldt dissocieret, dvs. α=1, og sammenhængen mellem Λ, Λ0 og α er således:
Λ0 for en elektrolyt er ligmed summen af elektrolyttens komponenter. Dette er Kohlrausch' lov. I praksis betyder det, at hvis man har elektrolytten AaBb, ser det således ud:
En måde at skrive dette på, som ses mange steder, er:
Brugen af Λ og λ ved ledningsevne ses lidt i flæng i undervisningsmateriale, hvad der kan give anledning til nogen forvirring. I dette materiale anvendes den almindelige internationale notation.
Mange λ0-værdier er noget man kan finde i opslagsværker, f.eks.
| Λ = | κ |
| C |
Under ideelle forhold burde man få den samme værdi for Λ for en elektrolyt, uanset koncentrationen man måler ved. Men, fordi ikke alle elektrolytter er stærke, og fordi ionerne påvirker hinanden i opløsningen, er dette ikke tilfældet. Man har derfor Λ0, som er den molære ledningsevne ved uendelig fortynding. Den uendelige fortynding, og praktiske i dette, kommer vil tilbage til længere nede.
Ved den ideale uendelige fortynding er en given elektrolyt fuldt dissocieret, dvs. α=1, og sammenhængen mellem Λ, Λ0 og α er således:
Λ = Λ0 · α
Λ0 for en elektrolyt er ligmed summen af elektrolyttens komponenter. Dette er Kohlrausch' lov. I praksis betyder det, at hvis man har elektrolytten AaBb, ser det således ud:
Λ0(AaBb) = a · λ0(A) + b · λ0(B)
En måde at skrive dette på, som ses mange steder, er:
Λ0 = ν+ · λ0+ + ν− · λ0−
Brugen af Λ og λ ved ledningsevne ses lidt i flæng i undervisningsmateriale, hvad der kan give anledning til nogen forvirring. I dette materiale anvendes den almindelige internationale notation.
Mange λ0-værdier er noget man kan finde i opslagsværker, f.eks.
| Λ0(Ag2CO3) | = 2 · λ0(Ag+) + λ0(CO32−) |
| = 2·61,9 S·cm²/mol + 138,6 S·cm²/mol | |
| = 262,4 S·cm²/mol |
Den uendelige fortynding i praksis
Begrebet den uendelige fortynding er egentlig et misvisende udtryk, idet man ved en uendelige fortynding i praksis ville ende med en måling for rent solvent for alle elektrolytter.
I praksis er den værdi man bestemmer for Λ0 en ekstrapolering af en række målinger til skæringen med y-aksen (0 mol/l), dvs. man laver en række målinger på opløsningers ledningsevne, udregner Λ, og plotter det i et koordinatsystem. For KCl og eddikesyre (HAc), får man noget der kunne ligne dette (model, ikke faktiske målinger):
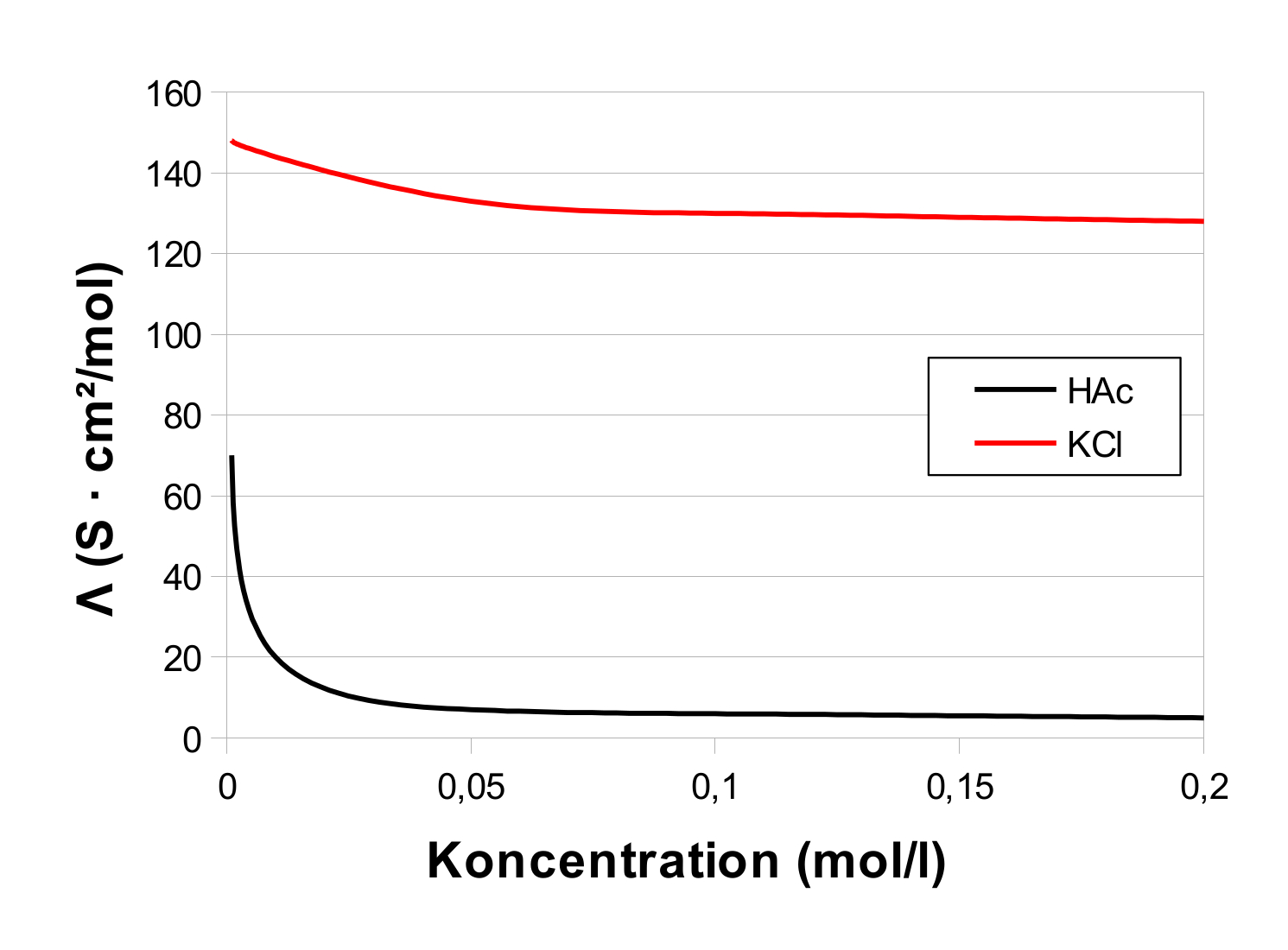
For KCl vil man, ved ekstrapoleringen til skæringen med y-aksen, kunne få den korrekte værdi på 149,9 S · cm²/mol, mens man for HAc ikke vil have nogen chance for at ramme den korrekte værdi på 390,7 S · cm²/mol.
Eksemplet demonstrerer også meget godt, hvorfor man ikke bestemmer Λ0 for svage elektrolytter ved direkte måling.
I praksis er den værdi man bestemmer for Λ0 en ekstrapolering af en række målinger til skæringen med y-aksen (0 mol/l), dvs. man laver en række målinger på opløsningers ledningsevne, udregner Λ, og plotter det i et koordinatsystem. For KCl og eddikesyre (HAc), får man noget der kunne ligne dette (model, ikke faktiske målinger):

For KCl vil man, ved ekstrapoleringen til skæringen med y-aksen, kunne få den korrekte værdi på 149,9 S · cm²/mol, mens man for HAc ikke vil have nogen chance for at ramme den korrekte værdi på 390,7 S · cm²/mol.
Eksemplet demonstrerer også meget godt, hvorfor man ikke bestemmer Λ0 for svage elektrolytter ved direkte måling.
Molar ledningsevne for svage elektrolytter
Hvis vi arbejder med svage elektrolytter, dvs. kemiske forbindelser der kun dissocierer delvis, f.eks. middelstærke syrer, er det ikke hensigtsmæssigt at måle direkte på fortyndingerne. Man kan godt foretage målingerne, men, som demonstreret oven over, skal man have noget der er nøjagtigt/anvendeligt, skal man benytte sig af et lille kunstgreb.
Til undervisningsbrug er det foretrukne eksempel bestemmelse af Λ0 for eddikesyre, bl.a. fordi det er velegnet til øvelser:
For eddikesyre er
Λ0(HAc) = λ0(H+) + λ0(Ac−)
Hvis man adderer Λ0(NaCl) på begge sider, kan man lave lidt matematisk omarrangering:
Λ0(HAc) + Λ0(NaCl) = λ0(H+) + λ0(Ac−) + Λ0(NaCl)
Så, ved at måle den molare ledningsevne for HCl, NaAc og NaCl, som alle tre er stærke elektrolytter, kan man bestemme den molare ledningsevne for den svage elektrolyt eddikesyre.
Til undervisningsbrug er det foretrukne eksempel bestemmelse af Λ0 for eddikesyre, bl.a. fordi det er velegnet til øvelser:
For eddikesyre er
Λ0(HAc) = λ0(H+) + λ0(Ac−)
Hvis man adderer Λ0(NaCl) på begge sider, kan man lave lidt matematisk omarrangering:
Λ0(HAc) + Λ0(NaCl) = λ0(H+) + λ0(Ac−) + Λ0(NaCl)
⇕
Λ0(HAc) + Λ0(NaCl) = λ0(H+) + λ0(Ac−) + λ0(Na+) + λ0(Cl−)⇕
Λ0(HAc) + Λ0(NaCl) = Λ0(HCl) + λ0(Ac−) + λ0(Na+)⇕
Λ0(HAc) + Λ0(NaCl) = Λ0(HCl) + Λ0(NaAc)⇕
Λ0(HAc) = Λ0(HCl) + Λ0(NaAc) - Λ0(NaCl)Så, ved at måle den molare ledningsevne for HCl, NaAc og NaCl, som alle tre er stærke elektrolytter, kan man bestemme den molare ledningsevne for den svage elektrolyt eddikesyre.