
Buffere
Syre/base-kemi
En kort intro
Buffere er blandinger af syrer og deres korresponderende baser, f.eks. eddikesyre og acetationer. Buffere har den egenskab, at de kan modvirke ændringer i pH, f.eks. ved reaktioner der afgiver syre eller base, og dermed sørge for at der holdes et mere eller mindre konstant pH i opløsningen. Buffervirkningen er en egenskab, der bl.a. udnyttes i biologiske systemer og industrielle processer og avancerede analyser.
På en titreringskurve som f.eks. denne for 5 ml eddikesyre (1 M opløsning) med NaOH (1 M opløsning)
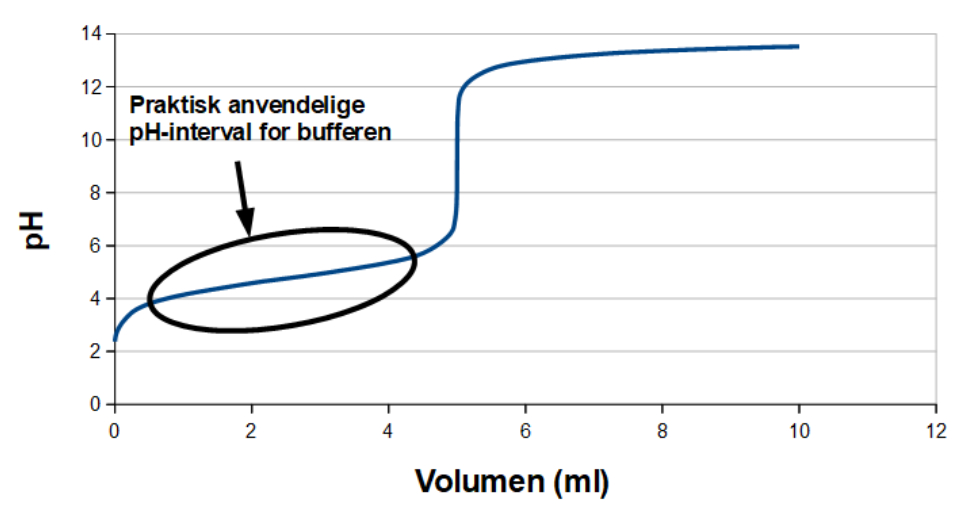
er opløsningen en buffer fra titreringen er startet og til lige før ekvivalenspunktet (ved 5 ml NaOH-opløsning).
I praksis er det anvendelige interval for bufferen lidt mindre, som det er markeret på titreringskurven. For at buffere skal fungere i praksis, skal man arbejde i det koncentrationsområde hvor pH ændres mindst ved tilsætning af syre eller base, dvs. det tilnærmelsesvis lineære område. For at have en buffervirkning der er så robust som muligt, er det i reglen altid bedst at grænsen for ens procesvindue ikke er det samme som grænsen for bufferens anvendelsesområde. Det er en rent sikkerhedsmæssig ting i procesteknologi, hvis der sker uheld eller uforudsete ting når den kemiske reaktion i bufferen er i gang.
Der er i sagens natur en grænse for hvor meget bufferen kan modvirke mængden af tilsat syre eller base. Dette hedder opløsningens bufferkapacitet og er afhængig af bufferens indhold af syre og base. Fordi der i reglen ikke er samme koncentration af syre og base, med mindre man er i punktet hvor pH = pKa, skal man man være opmærksom på, at bufferens bufferkapacitet ikke nødvendigvis er det sammen for syrer og baser.
I stedet for det engelske navn buffer, ser man også fra tid til anden, det tyske puffer anvendt om opløsningerne. Især i ældre litteratur. På dansk er begge navne korrekt, og kan anvendes efter behag. I dette materiale bruges navnet buffer.
Fordi en buffer som f.eks. acetatbufferen af eddikesyre og acetat, har et relativt snævert pH-interval at fungere i, har man en lang række buffersystemer, afhængig af hvilken pH-værdi man har brug for at holde til sin reaktion. Man kan finde flere forskellige buffersystemer til et givent pH-niveau, og man skal være opmærksom på, at der kan være sidereaktioner med bufferen, som påvirker den primære reaktion. Man ser det bl.a. ved krystallisering af makromolekyler til røntgenkrystallografi, hvor forskellen i buffertype alene, kan være forskellen på om man får dannet krystaller eller ej.
Buffertyper og deres pH-niveau er noget man kan slå op, og man kan købe færdige kit, hvor man blot hælder indholdet af en pose ned i en specificeret mængde vand, og så er bufferen klar, når indholdet er opløst.
På en titreringskurve som f.eks. denne for 5 ml eddikesyre (1 M opløsning) med NaOH (1 M opløsning)

er opløsningen en buffer fra titreringen er startet og til lige før ekvivalenspunktet (ved 5 ml NaOH-opløsning).
I praksis er det anvendelige interval for bufferen lidt mindre, som det er markeret på titreringskurven. For at buffere skal fungere i praksis, skal man arbejde i det koncentrationsområde hvor pH ændres mindst ved tilsætning af syre eller base, dvs. det tilnærmelsesvis lineære område. For at have en buffervirkning der er så robust som muligt, er det i reglen altid bedst at grænsen for ens procesvindue ikke er det samme som grænsen for bufferens anvendelsesområde. Det er en rent sikkerhedsmæssig ting i procesteknologi, hvis der sker uheld eller uforudsete ting når den kemiske reaktion i bufferen er i gang.
Der er i sagens natur en grænse for hvor meget bufferen kan modvirke mængden af tilsat syre eller base. Dette hedder opløsningens bufferkapacitet og er afhængig af bufferens indhold af syre og base. Fordi der i reglen ikke er samme koncentration af syre og base, med mindre man er i punktet hvor pH = pKa, skal man man være opmærksom på, at bufferens bufferkapacitet ikke nødvendigvis er det sammen for syrer og baser.
I stedet for det engelske navn buffer, ser man også fra tid til anden, det tyske puffer anvendt om opløsningerne. Især i ældre litteratur. På dansk er begge navne korrekt, og kan anvendes efter behag. I dette materiale bruges navnet buffer.
Fordi en buffer som f.eks. acetatbufferen af eddikesyre og acetat, har et relativt snævert pH-interval at fungere i, har man en lang række buffersystemer, afhængig af hvilken pH-værdi man har brug for at holde til sin reaktion. Man kan finde flere forskellige buffersystemer til et givent pH-niveau, og man skal være opmærksom på, at der kan være sidereaktioner med bufferen, som påvirker den primære reaktion. Man ser det bl.a. ved krystallisering af makromolekyler til røntgenkrystallografi, hvor forskellen i buffertype alene, kan være forskellen på om man får dannet krystaller eller ej.
Buffertyper og deres pH-niveau er noget man kan slå op, og man kan købe færdige kit, hvor man blot hælder indholdet af en pose ned i en specificeret mængde vand, og så er bufferen klar, når indholdet er opløst.
pH-beregninger på buffere
pH-beregninger for buffere gøres med formlen
eller alternativt
fordi det samlede volumen er det samme for syren og basen, og derfor kan forkortes væk.
Hvordan man griber udregningen an, kommer an på forholdene. Er det blot syren og dens korresponderende base der blandes i et specifikt forhold, er det blot at indsætte moltal eller koncentrationer og lave udregningen. Er det en syre eller base der titreres, skal det laves som en stoechiometrisk beregning, inden man indsætter i formlen. Lad os se på et par eksempler:
Hvis man tager 0,50 l af en 1,00 M eddikesyre (pKa=4,75), og tilsætter 20,50 g vandfrit NaAc (0,25 mol), så er n(HAc) = 0,50 mol og vi kan finde pH som
Det kunne også være 0,50 l af en 0,50 M eddikesyre, som titreres med 100 ml af en 1,00 M NaOH-opløsning. I så fald, er man nødt til at starte med reaktionsligningen og de stoechiometriske beregninger. Den del ser således ud:
Vi kan nu indsætte i formlen for pH for buffere:
Det behøver ikke være pH man er interesseret i at beregne. Er det nu i stedet en ukendt pKa man er interesseret i at bestemme, eller koncentrationen af syren og/eller basen i opløsningen, er det blot at indsætte i formlen og regne på det som en ligning med én ubekendt.
| pH = pKa + log | [base] |
| [syre] |
eller alternativt
| pH = pKa + log | n(base) |
| n(syre) |
fordi det samlede volumen er det samme for syren og basen, og derfor kan forkortes væk.
Hvordan man griber udregningen an, kommer an på forholdene. Er det blot syren og dens korresponderende base der blandes i et specifikt forhold, er det blot at indsætte moltal eller koncentrationer og lave udregningen. Er det en syre eller base der titreres, skal det laves som en stoechiometrisk beregning, inden man indsætter i formlen. Lad os se på et par eksempler:
Hvis man tager 0,50 l af en 1,00 M eddikesyre (pKa=4,75), og tilsætter 20,50 g vandfrit NaAc (0,25 mol), så er n(HAc) = 0,50 mol og vi kan finde pH som
| pH = 4,75 + log | 0,25 mol | = 4,75 + log(0,50) = 4,5 |
| 0,50 mol |
Det kunne også være 0,50 l af en 0,50 M eddikesyre, som titreres med 100 ml af en 1,00 M NaOH-opløsning. I så fald, er man nødt til at starte med reaktionsligningen og de stoechiometriske beregninger. Den del ser således ud:
| HAc(aq) | + | OH−(aq) |  | Ac−(aq) | + | H2O(l) | |
| Start | 0,25 mol | - | - | - | |||
| Tilsat | - | 0,10 mol | - | - | |||
| Slut | 0,15 mol | 0,00 mol | 0,10 mol | 0,10 mol |
Vi kan nu indsætte i formlen for pH for buffere:
| pH = 4,75 + log | 0,10 mol | = 4,75 + log(0,67) = 4,6 |
| 0,15 mol |
Det behøver ikke være pH man er interesseret i at beregne. Er det nu i stedet en ukendt pKa man er interesseret i at bestemme, eller koncentrationen af syren og/eller basen i opløsningen, er det blot at indsætte i formlen og regne på det som en ligning med én ubekendt.