
Titreringer af syrer og baser
Syre/base-kemi
Hvad går det ud på?
Titreting er egentlig en teknik til bestemmelse af koncentrationer af en given komponent, dvs. det der hedder en kvantitativ analyse. De fleste der har prøvet titrering i skolen forbinder titreringer med syrer og baser, hvor man bestemmer syrekoncentrationer, ved tilsættelse af kendt mængde base til man når ækvivalenspunktet, eller omvendt. Det behøver imidlertid ikke at være syrer og baser, man har f.eks. og redoxtitreringer, hvor man måler på andre indholdsstoffer, det bliver gennemgået under redox. Titreringer kan også bruges til kvalitative analyser, dvs. stofidentifikation, for svage og middelstærke syrer. De kvalitative analyser forudsætter, at man ved titreringen kan se alle pKa- eller pKb-værdier, så der er begrænsninger på anvendeligheden som kvalitativ analyse.
Titreringskurver
Det letteste måde at forstå titreringerne på, er ved at se på nogle titreringskurver.
Hvis vi starter helt simpelt med en stærk monovalent syre, f.eks. 5 ml HCl (1 M opløsning), som vi titrerer med en stærk base, f.eks. NaOH (1 M opløsning), så ser den overordnede titreringskurve således ud:
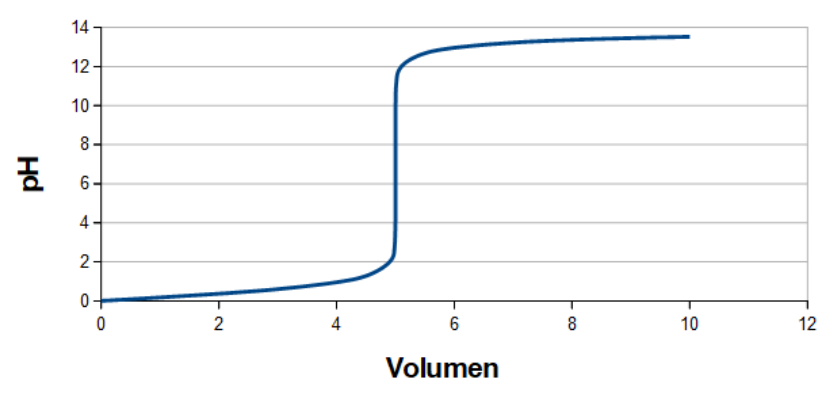
Som det ses, er titreringskurven ikke lineær. Titreringskurver er ikke lineære. Der hvor kurven stiger næsten lodret (eller tilnærmelsesvis lodret) har man ekvivalenspunktet. Det er her moltallet for syre er lig moltallet for base, dvs. n(syre)=n(base), som vi bruger i de stoechiometriske beregninger (kommer længere nede). Havde det været det omvendte, dvs. 1 M NaOH titreret med 1 M HCl, havde vi fået en lignende kurve, blot var den startet ved pH 14 og endt ved pH 0,5.
En vigtig detalje: Man titrerer i reglen altid med stærke syrer og baser! Det er en rent praktisk ting. Hvis man titrerer svage eller middelstærke syrer/baser med modsvarende svage eller middelstærke syrer/baser, skal man til at regne på to ligevægte, der påvirker hinanden, og ekvivalenspunkterne bliver svære eller umulige at aflæse. Principielt kan man godt gøre det, og neutralisering med svage og middelstærke syrer og baser har også praktiske anvendelser, f.eks. afkalkning med eddike- eller citronsyre. Blot ikke til analysekemiske opgaver. Til titreringer som i kvantitativ og kvalitativ analyse, hvor nøjagtighed er et kardinalpunkt, er det nødvendigt med stærke syrer og baser.
Skal vi titrere en middelstærke eller svag syre (eller base), bliver det straks lidt mere kompliceret. Fordi de ikke dissocierer helt, har man ved start en svag/middelstærk syre i ligevægt med sig selv, men så snart man begynder at titrere på den, har man en ligevægt af en syre og dens korresponderende base, dvs. en buffer. Ligevægte er temperaturafhængige, så man kan derfor også forvente, at titreringskurverne er temperaturafhængige! For titrering af 5 ml eddikesyre (1 M opløsning) med NaOH (1 M opløsning) ved stuetemp. ser det således ud:
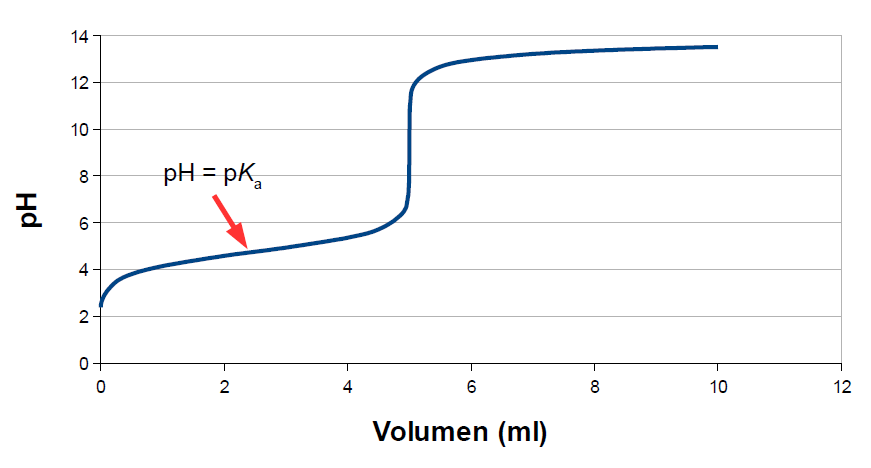
Fordi det er en buffer, er der halvvejs i titreringen et vigtigt punkt (markeret med den røde pil). Det er her hvor koncentrationen af syre er lig med koncentrationen af base, så pH = pKa. Det betyder, at hvis man laver en titreringskurve for en ukendt syre, kan man bestemme pKa og dermed identificere syren. Metoden er i sagens natur behæftet med noget usikkerhed, fordi man aflæser på en graf, så i praksis vil det antageligt ikke være den eneste analyse man laver til identifikationen. Er det en polyvalent syre (eller base) ligger de efterfølgende pKa-værdier midt mellem ekvivalenspunkterne (vises lidt længere nede).
Lige i ekvivalenspunktet har man en svag/middelstærk base, afhængig af hvad den korresponderende base var. Her er det acetationen, med pKb på 9,25, og vi har fordoblet volumen ved titreringen, så den formelle koncentration er 0,5 M. Efter ekvivalenspunktet, har man en svag base plus en stærk base, hvor den stærke base hurtigt bliver den dominerende og man regner det herfra som en stærk base.
Titrerer man en divalent syre, får man i teorien en titreringkurve som med de svage/middelstærke syrer, blot med to ekvivalenspunkter. I praksis er det kun nogle af de divalente syrer, hvor kan se omslaget som en brat stigning i pH. Det fungerer f.eks. for maleinsyre (ethan-disyre), hvor pKa1 og pKa2 er hhv. 1,91 og 6,33 ved stuetemp. Den titreringskurve ser omtrent således ud:
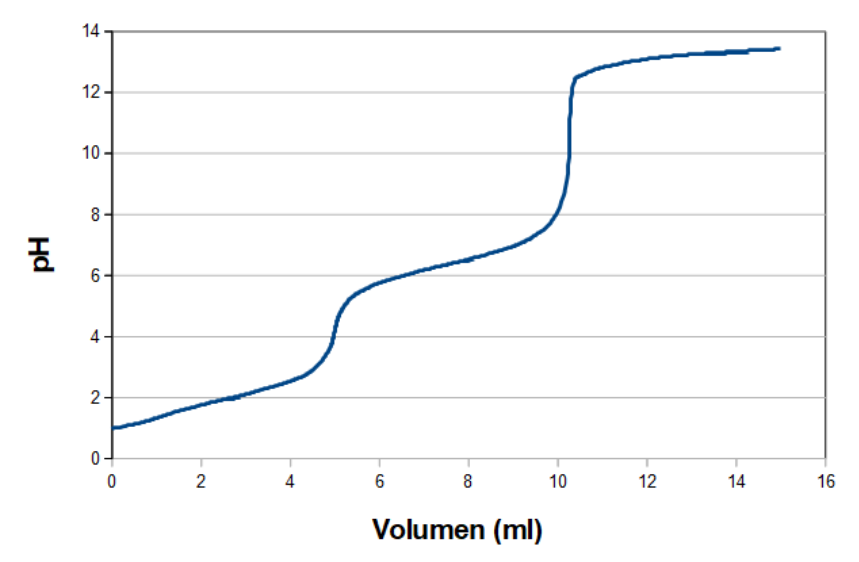
Hvis de to pKa-værdier ligger for tæt på hinanden, kan det være svært eller umuligt at aflæse pKa-værdierne. Malonsyre (propan-disyre), hvor pKa1 og pKa2 er hhv. 2,83 og 5,69, har en titreringskurve der ser omtrent således ud ved stuetemp.:
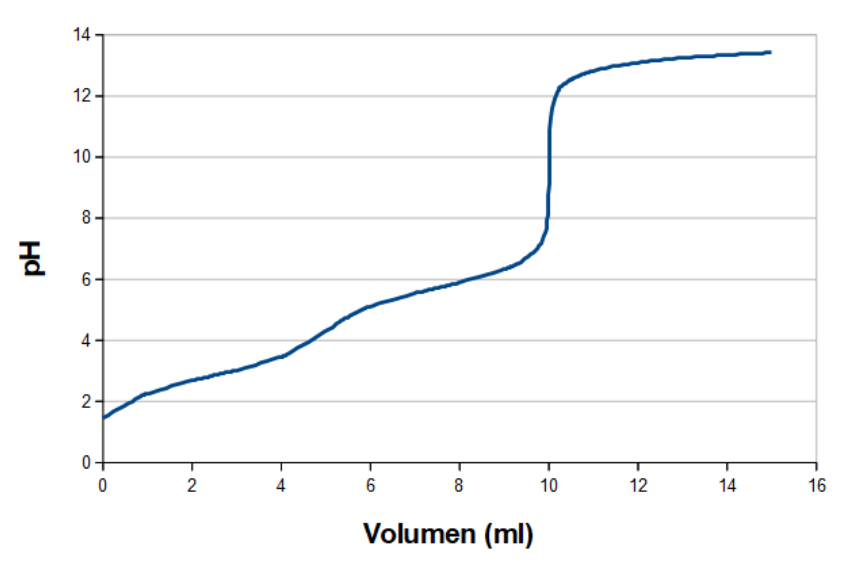
Det første ekvivalenspunkt og pKa1 er ikke tydelige at se, som ved maleinsyren. Fordi det andet ekvivalenspunkt er tydeligt, kan man regne sig frem til, at det første ekvivalenspunkt må være ved den halve mængde base, og så ved man også, at pKa1 og pKa2 ligger hhv. midt mellem start og første ekvivalenspunkt og midt mellem de to ekvivalenspunkter. Man kan derfor ræsonnere sig frem til de oplysninger der ikke tydeligt fremgår af titreringskurven, men det er en udledning af hvor punkterne må ligge, og ikke en aflæsning.
Hvis vi starter helt simpelt med en stærk monovalent syre, f.eks. 5 ml HCl (1 M opløsning), som vi titrerer med en stærk base, f.eks. NaOH (1 M opløsning), så ser den overordnede titreringskurve således ud:

Som det ses, er titreringskurven ikke lineær. Titreringskurver er ikke lineære. Der hvor kurven stiger næsten lodret (eller tilnærmelsesvis lodret) har man ekvivalenspunktet. Det er her moltallet for syre er lig moltallet for base, dvs. n(syre)=n(base), som vi bruger i de stoechiometriske beregninger (kommer længere nede). Havde det været det omvendte, dvs. 1 M NaOH titreret med 1 M HCl, havde vi fået en lignende kurve, blot var den startet ved pH 14 og endt ved pH 0,5.
En vigtig detalje: Man titrerer i reglen altid med stærke syrer og baser! Det er en rent praktisk ting. Hvis man titrerer svage eller middelstærke syrer/baser med modsvarende svage eller middelstærke syrer/baser, skal man til at regne på to ligevægte, der påvirker hinanden, og ekvivalenspunkterne bliver svære eller umulige at aflæse. Principielt kan man godt gøre det, og neutralisering med svage og middelstærke syrer og baser har også praktiske anvendelser, f.eks. afkalkning med eddike- eller citronsyre. Blot ikke til analysekemiske opgaver. Til titreringer som i kvantitativ og kvalitativ analyse, hvor nøjagtighed er et kardinalpunkt, er det nødvendigt med stærke syrer og baser.
Skal vi titrere en middelstærke eller svag syre (eller base), bliver det straks lidt mere kompliceret. Fordi de ikke dissocierer helt, har man ved start en svag/middelstærk syre i ligevægt med sig selv, men så snart man begynder at titrere på den, har man en ligevægt af en syre og dens korresponderende base, dvs. en buffer. Ligevægte er temperaturafhængige, så man kan derfor også forvente, at titreringskurverne er temperaturafhængige! For titrering af 5 ml eddikesyre (1 M opløsning) med NaOH (1 M opløsning) ved stuetemp. ser det således ud:

Fordi det er en buffer, er der halvvejs i titreringen et vigtigt punkt (markeret med den røde pil). Det er her hvor koncentrationen af syre er lig med koncentrationen af base, så pH = pKa. Det betyder, at hvis man laver en titreringskurve for en ukendt syre, kan man bestemme pKa og dermed identificere syren. Metoden er i sagens natur behæftet med noget usikkerhed, fordi man aflæser på en graf, så i praksis vil det antageligt ikke være den eneste analyse man laver til identifikationen. Er det en polyvalent syre (eller base) ligger de efterfølgende pKa-værdier midt mellem ekvivalenspunkterne (vises lidt længere nede).
Lige i ekvivalenspunktet har man en svag/middelstærk base, afhængig af hvad den korresponderende base var. Her er det acetationen, med pKb på 9,25, og vi har fordoblet volumen ved titreringen, så den formelle koncentration er 0,5 M. Efter ekvivalenspunktet, har man en svag base plus en stærk base, hvor den stærke base hurtigt bliver den dominerende og man regner det herfra som en stærk base.
Titrerer man en divalent syre, får man i teorien en titreringkurve som med de svage/middelstærke syrer, blot med to ekvivalenspunkter. I praksis er det kun nogle af de divalente syrer, hvor kan se omslaget som en brat stigning i pH. Det fungerer f.eks. for maleinsyre (ethan-disyre), hvor pKa1 og pKa2 er hhv. 1,91 og 6,33 ved stuetemp. Den titreringskurve ser omtrent således ud:

Hvis de to pKa-værdier ligger for tæt på hinanden, kan det være svært eller umuligt at aflæse pKa-værdierne. Malonsyre (propan-disyre), hvor pKa1 og pKa2 er hhv. 2,83 og 5,69, har en titreringskurve der ser omtrent således ud ved stuetemp.:

Det første ekvivalenspunkt og pKa1 er ikke tydelige at se, som ved maleinsyren. Fordi det andet ekvivalenspunkt er tydeligt, kan man regne sig frem til, at det første ekvivalenspunkt må være ved den halve mængde base, og så ved man også, at pKa1 og pKa2 ligger hhv. midt mellem start og første ekvivalenspunkt og midt mellem de to ekvivalenspunkter. Man kan derfor ræsonnere sig frem til de oplysninger der ikke tydeligt fremgår af titreringskurven, men det er en udledning af hvor punkterne må ligge, og ikke en aflæsning.
Koncentrationsbestemmelse ved titreringer
En af de stoechiometriske beregninger man bruger titreringerne til, er koncentrationsbestemmelse af syrer og baser i opløsninger. Det kan f.eks. være til kvalitetssikring af produkter, hvor man kontrollerer om indholdet af syre/base er inden for specifikationerne, eller f.eks. kontrol af udledninger af syre fra store skibes skrubberanlæg.
Måden man griber det an på, er ved at tage en kendt mængde af opløsningen, det kunne f.eks. være 100 ml æbleeddike, som iflg. deklarationen indeholder 5 % syre. Syren i æbleeddike er eddikesyre.
Ved titrering med en 1,0 M NaOH opløsning, er ekvivalenspunktet ved 83,2 ml, svarende til 83,2 · 10−3 mol OH-. Så, hvis vi starter med at skrive moltallene:
Af reaktionsskemaet, kan vi se, at n(HAc) = n(OH-) = 83,2 · 10−3 mol, dvs.:
Molmassen for eddikesyre er 60,05 g/mol, så m(HAc) = n(HAc) · M(HAc) = 5,0 g. Dette er i 100 ml æbleeddike med en densitet på 1,0 dvs. 100 g æbleeddike, så indholdet af eddikesyre er 5 % (vægtprocent), som det skal være iflg. varedeklarationen.
Måden man griber det an på, er ved at tage en kendt mængde af opløsningen, det kunne f.eks. være 100 ml æbleeddike, som iflg. deklarationen indeholder 5 % syre. Syren i æbleeddike er eddikesyre.
Ved titrering med en 1,0 M NaOH opløsning, er ekvivalenspunktet ved 83,2 ml, svarende til 83,2 · 10−3 mol OH-. Så, hvis vi starter med at skrive moltallene:
| HAc(aq) | + OH−(aq) |  | H2O(l) | + Ac−(aq) | |
| Start | ? | ||||
| Tilsat | 83,2 · 10−3 mol | ||||
| Slut | 0,0 mol | 83,2 · 10−3 mol | 83,2 · 10−3 mol |
Af reaktionsskemaet, kan vi se, at n(HAc) = n(OH-) = 83,2 · 10−3 mol, dvs.:
| HAc(aq) | + OH−(aq) |  | H2O(l) | + Ac−(aq) | |
| Start | 83,2 · 10−3 mol | ||||
| Tilsat | 83,2 · 10−3 mol | ||||
| Slut | 0,0 mol | 83,2 · 10−3 mol | 83,2 · 10−3 mol |
Molmassen for eddikesyre er 60,05 g/mol, så m(HAc) = n(HAc) · M(HAc) = 5,0 g. Dette er i 100 ml æbleeddike med en densitet på 1,0 dvs. 100 g æbleeddike, så indholdet af eddikesyre er 5 % (vægtprocent), som det skal være iflg. varedeklarationen.
Tilbagetitrering
Der kan være situationer, hvor man ikke kan lave en titrering direkte på det man gerne vil analysere.
Det kan være fordi man skal lave en indirekte måling, f.eks. syreudvikling i en reaktion, hvor man leder over i et overskud af base (kendt mængde) og titrerer på overskuddet, så man kan udregne hvor meget syre der blev dannet under reaktionen. Kjeldahl-analysen er en sådan analyse, bortset fra at her er det en base der dannes (NH3) og ledes over i en syre (HCl).
Det kan også være fordi syren eller basen er uopløselig i vand, og skal gøres opløselig. Titrering af benzen-disyre i næste afsnit er et eksempel på dette.
Det kan være fordi man skal lave en indirekte måling, f.eks. syreudvikling i en reaktion, hvor man leder over i et overskud af base (kendt mængde) og titrerer på overskuddet, så man kan udregne hvor meget syre der blev dannet under reaktionen. Kjeldahl-analysen er en sådan analyse, bortset fra at her er det en base der dannes (NH3) og ledes over i en syre (HCl).
Det kan også være fordi syren eller basen er uopløselig i vand, og skal gøres opløselig. Titrering af benzen-disyre i næste afsnit er et eksempel på dette.
Bjerrumdiagrammer
En alternativ måde at vise titreringskurver på, er et Bjerrumdiagram (opkaldt efter den danske kemiker Niels Bjerrum). Metoden fungerer kun for svage og middelstærke syrer og baser, hvor man under titreringen har en ligevægt mellem en syre og dens korresponderende base. Hvor man på den almindelige titreringskurve har pH og titratorvolumen, bruger man på Bjerrumdiagrammet molbrøken som funktion af pH. For eddikesyre ser Bjerrumdiagrammet således ud:
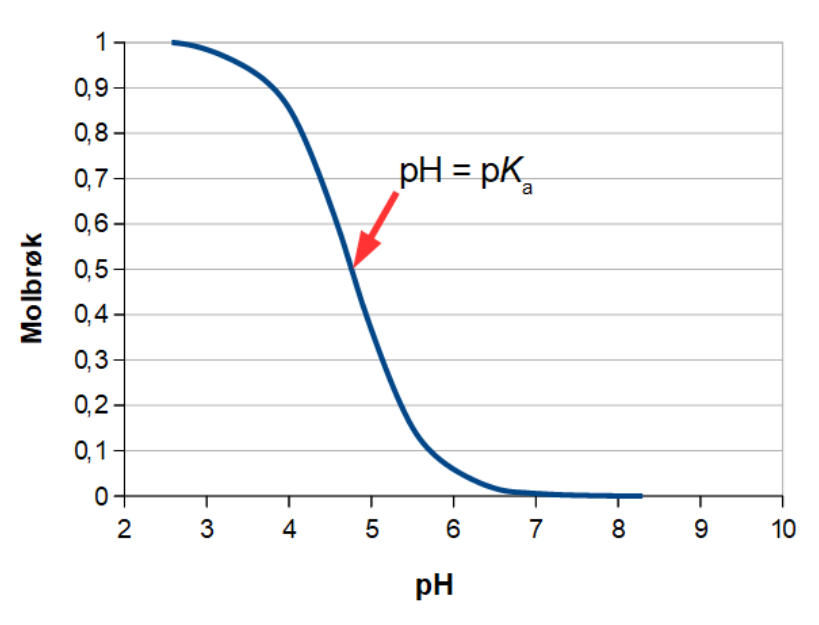
Fordi det er en buffer man arbejder med, frem til ækvivalenspunktet, ved man også, at ved molbrøken 0,5, X(eddikesyre) = 0,5 i eksemplet, er pH = pKa. Har man divalente og trivalente syrer og baseer, vil man i Bjerrumdiagrammet indsætte de hhv. 2 og 3 kurver for titreringerne til hhv. 2. og 3. ækvivalenspunkt. Metoden er mest udbredt til undervisning i kemi, da den er meget illustrativ i forhold til eksperimentel bestemmelse af pKa for en given syre, eller pKb for en given base. Til almindeligt laboratoriearbejde bruges Bjerrumdiagrammer kun i meget ringe udstrækning.

Fordi det er en buffer man arbejder med, frem til ækvivalenspunktet, ved man også, at ved molbrøken 0,5, X(eddikesyre) = 0,5 i eksemplet, er pH = pKa. Har man divalente og trivalente syrer og baseer, vil man i Bjerrumdiagrammet indsætte de hhv. 2 og 3 kurver for titreringerne til hhv. 2. og 3. ækvivalenspunkt. Metoden er mest udbredt til undervisning i kemi, da den er meget illustrativ i forhold til eksperimentel bestemmelse af pKa for en given syre, eller pKb for en given base. Til almindeligt laboratoriearbejde bruges Bjerrumdiagrammer kun i meget ringe udstrækning.
Forskellen på teori og praksis, og hvor galt det kan gå
Som vist med maleinsyren længere oppe, kan man via en titreringskurve identificere en syre eller base ved at aflæse pKa-værdien, eller -værdierne hvis syren/basen er polyvalent. Men for at titrere, skal syren/basen være opløst i vandet, så hvad gør man med en syre/base, hvor opløseligheden i vand er lav? Man laver et lille kunstgreb med en tilbagetitrering hvor man tilsætter et overskud af base og titrerer på denne opløsning med en syre.
Syren benzen-disyre findes som tre isomerer, hvor de to syregrupper sidder enten ortho, meta eller para. Disse kaldes bl.a. hhv. phthalsyre, isophthalsyre og therephthalsyre. Fælles for isomererne er, at opløseligheden i vand er lav, og for at kunne titrere syregrupperne, er syren nødt til at være opløst i vand.
Det man så gør, er først at overtitrere disyren med stærk base, så molekylet går fra sin syreform med to COOH-grupper til baseformen med to COO−-grupper. Vi har nu al disyren på den vandopløselige form, som den korresponerende base, plus noget OH− fra overskuddet af stærk base. Dette tilbagetitrerer man så med stærk syre, f.eks. HCl.
Så langt er teori og praksis i overensstemmelse.
Til modellen her under, er koncentrationerne af OH− og disyren på baseform begge sat til 1 M, og vi titrerer med en 1 M stærk syre. Så burde de tre titreringskurver for tilbagetitreringerne i teorien se omtrent såldes ud:
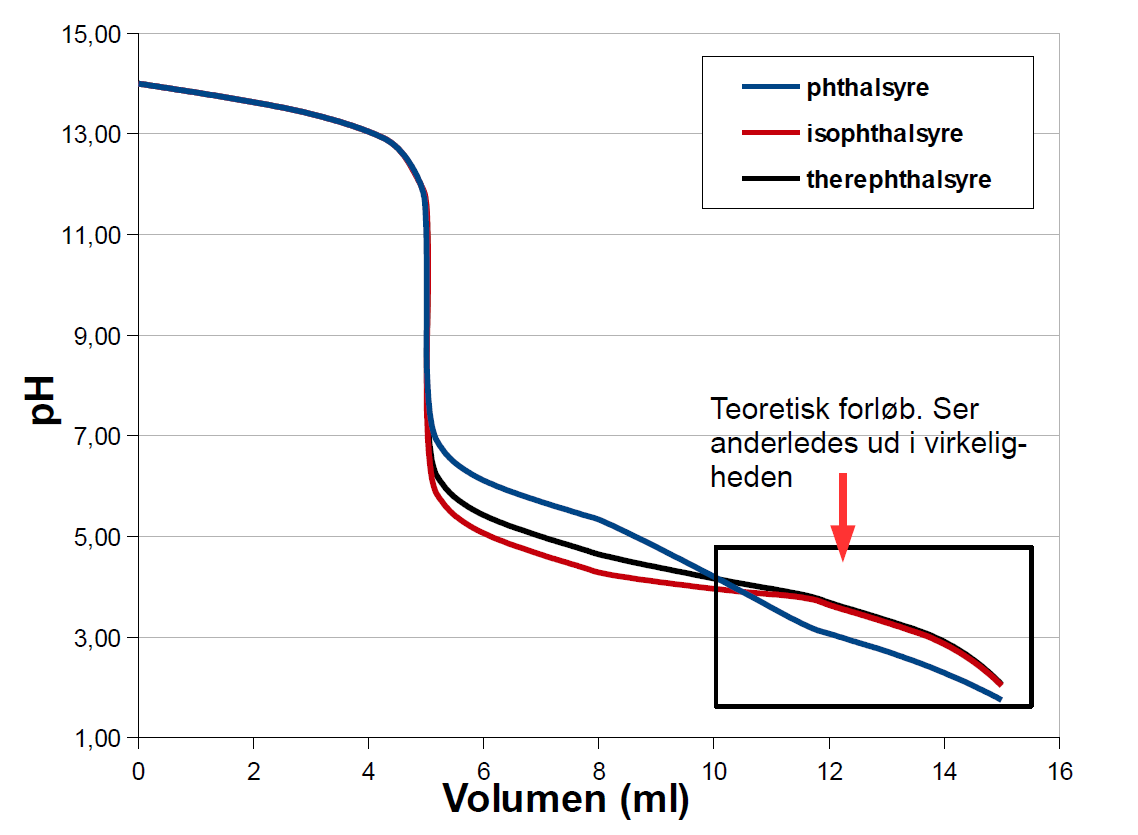
I virkeligheden ser titreringskurverne ikke helt sådan ud. Frem til andet ekvivalenspunkt ved 10 ml, hvor de tre disyrer vil være amfolytter, vil kurverne passe nogenlunde med virkeligheden. Herefter vil syreformens opløselighed begynde at påvirke resultatet.
Opløsligheden af de tre syrer på syreform ligger langt under den teoretiske slutkoncentration på 0,25 M. De lave slutværdier for pH der er vist, lader sig derfor ikke gøre i virkeligheden. Phthalsyre, som er den mest opløselige at syrerne kan komme ned omkring pH 2,1 for en mættet opløsning. Der sker det, at normalt, når man titrerer i bufferområdet som vist her, så stiger koncentrationen af syren, mens koncentrationen af den korresponderende base falder. Det er det vi normalt udnytter i bufferligningen:
hvor c(syre) = [syre] + [base].
Men fordi opløseligheden af syreformen er så lav som den er, rammer man hurtigt en maksimal koncentration af syre i bufferligningen, hvorefter syren fælder ud i takt med at den dannes, og koncentrationerne af syre og base ikke længere er omvendt proportionale. Den aktuelle koncentration af syre, [syre], bliver en konstant og den aktuelle koncentration af base, [base], men bliver lineært aftagende. Udfældningen ses ved at opløsningen begynder at blive mælket og uklar, for til sidst at blive helt hvid, hvis mængden af uopløselig syre er høj nok.
DERFOR: Ved titreringer, vær opmærksom på sekundære reaktioner, f.eks. udfældninger, fasesepareringer, afgasninger og komplekdannelser, som kan påvirke titreringen/titreringskurven!
Syren benzen-disyre findes som tre isomerer, hvor de to syregrupper sidder enten ortho, meta eller para. Disse kaldes bl.a. hhv. phthalsyre, isophthalsyre og therephthalsyre. Fælles for isomererne er, at opløseligheden i vand er lav, og for at kunne titrere syregrupperne, er syren nødt til at være opløst i vand.
Det man så gør, er først at overtitrere disyren med stærk base, så molekylet går fra sin syreform med to COOH-grupper til baseformen med to COO−-grupper. Vi har nu al disyren på den vandopløselige form, som den korresponerende base, plus noget OH− fra overskuddet af stærk base. Dette tilbagetitrerer man så med stærk syre, f.eks. HCl.
Så langt er teori og praksis i overensstemmelse.
Til modellen her under, er koncentrationerne af OH− og disyren på baseform begge sat til 1 M, og vi titrerer med en 1 M stærk syre. Så burde de tre titreringskurver for tilbagetitreringerne i teorien se omtrent såldes ud:

I virkeligheden ser titreringskurverne ikke helt sådan ud. Frem til andet ekvivalenspunkt ved 10 ml, hvor de tre disyrer vil være amfolytter, vil kurverne passe nogenlunde med virkeligheden. Herefter vil syreformens opløselighed begynde at påvirke resultatet.
Opløsligheden af de tre syrer på syreform ligger langt under den teoretiske slutkoncentration på 0,25 M. De lave slutværdier for pH der er vist, lader sig derfor ikke gøre i virkeligheden. Phthalsyre, som er den mest opløselige at syrerne kan komme ned omkring pH 2,1 for en mættet opløsning. Der sker det, at normalt, når man titrerer i bufferområdet som vist her, så stiger koncentrationen af syren, mens koncentrationen af den korresponderende base falder. Det er det vi normalt udnytter i bufferligningen:
| pH = pKa + log | [base] |
| [syre] |
hvor c(syre) = [syre] + [base].
Men fordi opløseligheden af syreformen er så lav som den er, rammer man hurtigt en maksimal koncentration af syre i bufferligningen, hvorefter syren fælder ud i takt med at den dannes, og koncentrationerne af syre og base ikke længere er omvendt proportionale. Den aktuelle koncentration af syre, [syre], bliver en konstant og den aktuelle koncentration af base, [base], men bliver lineært aftagende. Udfældningen ses ved at opløsningen begynder at blive mælket og uklar, for til sidst at blive helt hvid, hvis mængden af uopløselig syre er høj nok.
DERFOR: Ved titreringer, vær opmærksom på sekundære reaktioner, f.eks. udfældninger, fasesepareringer, afgasninger og komplekdannelser, som kan påvirke titreringen/titreringskurven!