
Strukturelementer
Polymerkemi
Hvad går det ud på?
Polymerernes modulsammensatte arkitektur betyder, at man er nødt til at dele strukturen op i strukturelementer, for at kunne beskrive polymeren og orientere sig i arkitekturen. Det er både et spørgsmål om at beskrive hvad der er backbone, eller hovedkæde (main chain), og hvad der er sidekæder (side chains), og hvordan kæderne folder op og de dannede strukturer orienterer sig i forhold til hinanden. Opfoldningen af polymerkæderne kaldes også polymerens konformation.
Ud over backbone og sidekæde i strukturen, taler man om polymerens primære, sekundære, tertiære og kvatenære strukturer. Begreberne backbone og sidekæde forvirres af, at de bruges lidt forskelligt, afhængig af polymertype og branche.
Vigtigheden af konformationsændringer, i forhold til ændringer af polymerens egenskaber, som følge af ydre påvirkninger, er relativt velbeskrevet for proteiner og polynucleotider, mens det for andre polymerer er en effekt man ofte ikke er opmærksom på.
Ud over backbone og sidekæde i strukturen, taler man om polymerens primære, sekundære, tertiære og kvatenære strukturer. Begreberne backbone og sidekæde forvirres af, at de bruges lidt forskelligt, afhængig af polymertype og branche.
Vigtigheden af konformationsændringer, i forhold til ændringer af polymerens egenskaber, som følge af ydre påvirkninger, er relativt velbeskrevet for proteiner og polynucleotider, mens det for andre polymerer er en effekt man ofte ikke er opmærksom på.
Den primære struktur
Den primære struktur er polymerkædens sekventielle opbygning, og er det eneste strukturelement, som alle polymerer har. Sædvanligvis refererer den primære struktur til monomersekvensen, men det behøver ikke at være tilfældet. Den primære struktur kan også referere til sekvenser af monomerer der gentages, som man kender det fra bl.a. visse polysaccharider (se nedenstående figur). Den mindste gentagne sekvens kalde polymerens basisenhed. I sjældne tilfælde kan basisenheden være mindre end monomeren. Det kender man fra bl.a. polyethylen og PTFE (polytetrafluoroethylen), hvor de gentagne enheder er hhv. -CH2- og -CF2- mens monomererne er hhv. -CH2-CH2- og -CF2-CF2-.
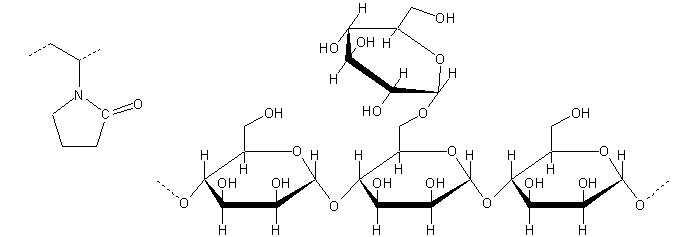
Venstre: Repterende enhed i PVP hvor den repterende enhed er det samme som monomeren.
Højre: Repterende enhed i locust bean gum (johannesbrødkernemel), hvor den repterende enhed er er en (1→4)-α-D-mannose trimer som hovedkæde med en α-D-galactose-(1→6) som sidekæde.

Øverst: Glycin
Nederst: Prolin
Monomerernes bevægelighed, dvs. steriske hindringer på rotation om bindingerne, elasticitet og bøjelighed, giver mange af polymerens egenskaber, og er bestemmende for hvilke muligheder der er for højere strukturelementer. Hvis vi ser på monomeren glycin (se fig. til højre) som findes i proteiner, er det en relativt bevægelig monomer (amidbindingen i polymeren giver lidt stivhed i strukturen). C-C-enkeltbindingerne har fuld drejelighed, og der er ingen funktionaliteter til sterisk at begrænse bevægelserne omkring bindingerne. Dette gør monomeren yderst fleksibel, når den er indsat i polymerer, og i proteiner er glycin udbredt hvor der ikke er brug for funktionaliteter eller hvor der er brug for en bøjning mellem to stive monomersekvenser. I den anden ende af skalaen er prolin (se fig. til højre). Den cyckliske form låser bindingen mellem C og N og begrænser bevægeligheden. Af netop denne grund, anvendes prolin ofte i proteiner til at give stivhed eller knæk i strukturerne.
Ved at vælge den rette monomersekvens, kan man styre opløseligheden i forskellige opløsningsmidler, krystalliniteten, den biologiske aktivitet, etc. Der er i sagens natur nogle begrænsninger på hvor meget man kan styre, f.eks. vil en polær linking af monomerer som f.eks. ether, ester og urethan give nogle begrænsninger i hvor upolær polymeren kan blive, ligesom at polyestre altid i et eller andet omfang vil være følsom overfor hydrolyse, alene fordi det er en ester.
Den primære struktur dikterer den overordnede polymertype. Homopolymerer er kun opbygget af én monomertype, modsat heteropolymerer. Heteropolymerer kaldes også co-polymerer, men det er mest et udtryk der anvendes for syntetiske polymerer. Man har også begrebet ter-polymerer, hvis der 3 forskellige monomerer i polymeren, men mange fortrækker stadig blot at kalde dem co-polymerer. Man deler co-polymerer ind i flg. undergrupper:
For at kunne give en fyldestgørende beskrivelse af den primære struktur, er det også nødvendigt med et mål for kædelængden. For små og veldefinerede molekyler angives molekylvægten. For polymerer, er dette sjældent muligt. I stedet angives den gennemsnitlige molekylvægt, og, hvis det er muligt, molekylvægtsfordelingen. Alternativet er at angive polymersationsgraden, DP (degree of polymerization), som angiver det gennemsnitlige antal monomerer i polymerkæden. Det er ikke en angivelse der bruges ret meget, men den kan have nogle fordele, f.eks. ved sammenligning af polymerer med forskellige monomerer.

Venstre: Repterende enhed i PVP hvor den repterende enhed er det samme som monomeren.
Højre: Repterende enhed i locust bean gum (johannesbrødkernemel), hvor den repterende enhed er er en (1→4)-α-D-mannose trimer som hovedkæde med en α-D-galactose-(1→6) som sidekæde.

Øverst: Glycin
Nederst: Prolin
Ved at vælge den rette monomersekvens, kan man styre opløseligheden i forskellige opløsningsmidler, krystalliniteten, den biologiske aktivitet, etc. Der er i sagens natur nogle begrænsninger på hvor meget man kan styre, f.eks. vil en polær linking af monomerer som f.eks. ether, ester og urethan give nogle begrænsninger i hvor upolær polymeren kan blive, ligesom at polyestre altid i et eller andet omfang vil være følsom overfor hydrolyse, alene fordi det er en ester.
Den primære struktur dikterer den overordnede polymertype. Homopolymerer er kun opbygget af én monomertype, modsat heteropolymerer. Heteropolymerer kaldes også co-polymerer, men det er mest et udtryk der anvendes for syntetiske polymerer. Man har også begrebet ter-polymerer, hvis der 3 forskellige monomerer i polymeren, men mange fortrækker stadig blot at kalde dem co-polymerer. Man deler co-polymerer ind i flg. undergrupper:
- Alternerende co-polymerer: veldefineret monomersekvens f.eks. -A-B-A-B-A-
- Random co-polymerer: tilfældig fordeling af monomererne f.eks. -A-A-B-A-B-A-A-B-B-
- Block co-polymerer: monomererne er samlet i blokke. De mest almindelige er tri-block, f.eks. A-A-A-A-A-B-B-B-B-B-A-A-A-A-A-, men både di-block og multi-block findes.
- Graft co-polymerer: polymer B er graftet på polymer A:
A-A-A-A-A-A-A
└B-B-B-B-B-B
For at kunne give en fyldestgørende beskrivelse af den primære struktur, er det også nødvendigt med et mål for kædelængden. For små og veldefinerede molekyler angives molekylvægten. For polymerer, er dette sjældent muligt. I stedet angives den gennemsnitlige molekylvægt, og, hvis det er muligt, molekylvægtsfordelingen. Alternativet er at angive polymersationsgraden, DP (degree of polymerization), som angiver det gennemsnitlige antal monomerer i polymerkæden. Det er ikke en angivelse der bruges ret meget, men den kan have nogle fordele, f.eks. ved sammenligning af polymerer med forskellige monomerer.
Sekundære strukturer
Sekundære strukturelementer er strukturer der formes af den primære struktur. Sædvanligvis er dette helixformationer og sheets (foldeblade på dansk ved proteiner), dvs. spiralformationer og flader. Den sekundære struktur er ikke nødvendigvis kun én polymer, men kan være bygget op af flere polymerer, som man kender det fra DNA'ets dobbelthelix (se nedenstående fig.). Fraværet af sekundære, eller højere, strukturelementer kaldes random coil.
Helixformationen kræver en nøjagtig placering af polymerkæderne så de linet op på en specifik måde, og strukturen er relativt fastlåst. Den fastlåste struktur kender man fra krystallinitet, og der er også reelt tale om en delvis krystallinitet i materialet. Dette bryder med den klassiske måde at se materialer på, som enten krystallinske eller amorfe, men at have grader af krystallinitet er helt almindeligt for visse polymerer.
Dannelsen af sekundære strukturelementer er meget forskellig fra polymer til polymer, og man kan ikke blot gå ud fra, at de dannes hvis man ændrer på parametre som f.eks. solvent og temperaturer. Proteiner er selvarrangerende, dvs. med mindre man forhindrer dannelsen af strukturelementer med f.eks. detergenter, folder de selv op. Polysaccharider som agar og carrageenan kræver vand og opvarmning og at man kommer over en kritisk koncentrationen, før de kan danne formstabile hydrogeler der er termoreversible. Er koncentrationen for lav, fungerer de i stedet som fortykningsmiddel. For polyethylen er den delvise krystallinitet et resultat af den rette formgivningsproces, både støbeproces og efterbehandling.
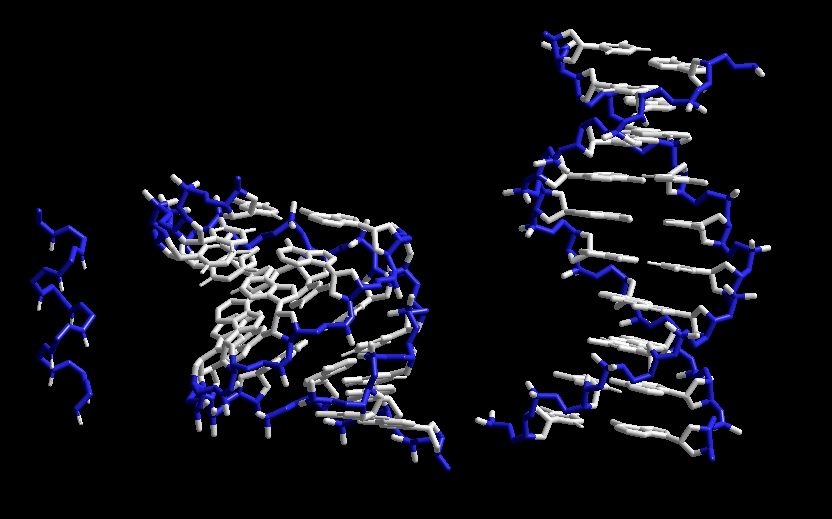
Eksempler på helixformationer. Backbone er markeret med blåt og sidekæder med hvidt.
Venstre: α-helix i protein.
Midt: A-form af DNA dobbelthelix.
Højre: B-form af DNA dobbelthelix.
Helixformationen kræver en nøjagtig placering af polymerkæderne så de linet op på en specifik måde, og strukturen er relativt fastlåst. Den fastlåste struktur kender man fra krystallinitet, og der er også reelt tale om en delvis krystallinitet i materialet. Dette bryder med den klassiske måde at se materialer på, som enten krystallinske eller amorfe, men at have grader af krystallinitet er helt almindeligt for visse polymerer.
Dannelsen af sekundære strukturelementer er meget forskellig fra polymer til polymer, og man kan ikke blot gå ud fra, at de dannes hvis man ændrer på parametre som f.eks. solvent og temperaturer. Proteiner er selvarrangerende, dvs. med mindre man forhindrer dannelsen af strukturelementer med f.eks. detergenter, folder de selv op. Polysaccharider som agar og carrageenan kræver vand og opvarmning og at man kommer over en kritisk koncentrationen, før de kan danne formstabile hydrogeler der er termoreversible. Er koncentrationen for lav, fungerer de i stedet som fortykningsmiddel. For polyethylen er den delvise krystallinitet et resultat af den rette formgivningsproces, både støbeproces og efterbehandling.

Eksempler på helixformationer. Backbone er markeret med blåt og sidekæder med hvidt.
Venstre: α-helix i protein.
Midt: A-form af DNA dobbelthelix.
Højre: B-form af DNA dobbelthelix.
Tertiære strukturer
Den tertiære struktur er polymerens overordnede form. Dette kunne være en globulær form (rund, omtrentlig sfærisk form) som ses ved mange proteiner, DNA super-helixen (en helixformation bestående af 2 helices), eller noget helt tredie.
Den tertiære struktur betragtes ofte som et resultat af organiseringen af de sekundære strukturelementer. Som det ses i f.eks. α-lactalbumin (nedenståenden fig.), er dette ikke helt korrekt. Disulfid-broer og elektrostatiske intereaktioner i form af fordelingen af monomerer så der dannes hydrofile og hydrofobe domæner bidrager lige så meget.
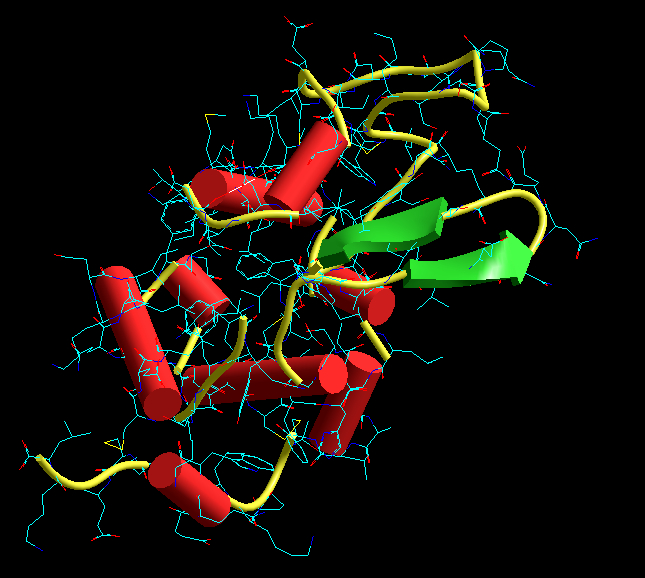
Proteinet α-lactalbumin som kroppen bruger til at omdanne glucose og galactose til lactose. Backbone er fremhævet med gult, α-helices er markeret med røde rør og β-sheets markeret med grønne pile.
Den tertiære struktur betragtes ofte som et resultat af organiseringen af de sekundære strukturelementer. Som det ses i f.eks. α-lactalbumin (nedenståenden fig.), er dette ikke helt korrekt. Disulfid-broer og elektrostatiske intereaktioner i form af fordelingen af monomerer så der dannes hydrofile og hydrofobe domæner bidrager lige så meget.

Proteinet α-lactalbumin som kroppen bruger til at omdanne glucose og galactose til lactose. Backbone er fremhævet med gult, α-helices er markeret med røde rør og β-sheets markeret med grønne pile.
Kvaternære strukturer
Kvaternære strukturer er et fænomen der primært ses i proteiner. Når flere proteiner med en veldefineret struktur sættes sammen i en ny veldefineret struktur, er det en kvaternær struktur.
Dannelsen af kvaternære strukturer er af stor vigtighed for aktiveringen og deaktiveringen af proteiner. Mange toksiner som bigift og slangegift bruger denne fremgangsmåde for at forhindre at dyret dør af sin egen gift. Ved denne type gift, har proteinet en skal-lignende struktur, med det aktive site i hulningen. På kanten af skallen, er der nogle hydrofobe monomerer, hvilket muliggør hydrofobe interaktioner. I giftsækken, hvor koncentrationen af gift er høj, aggregerer molekylerne og danner dimerer eller trimerer, afhængig af giften, med den hule side pegende indad mod midten, således at det aktive site afskærmes fra substratet og giften derved inaktiveres. Ved lave koncentrationer, f.eks. slangegiften der kommer ind i byttedyrets blodbane, falder aggregeringen fra hinanden, og det aktive site bliver blotlagt og giften er aktiv.
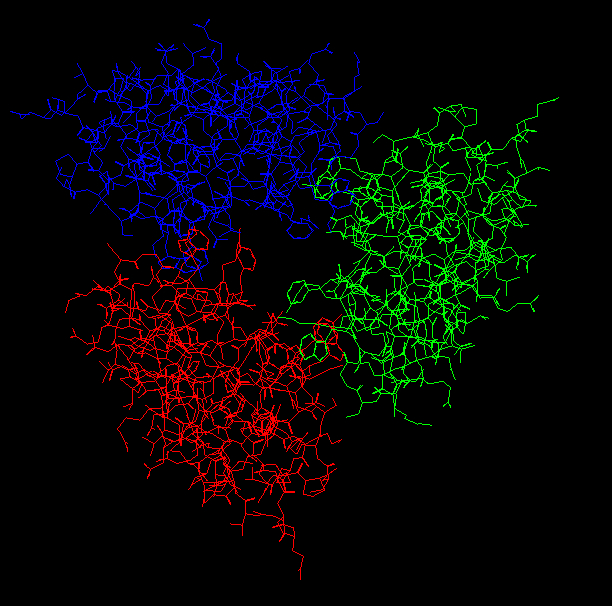
Krystalstruktur af giften fra den indiske cobra (Naja naja naja) i dens kvartenære form. De individuelle giftmolekyler er farvet rød, grøn og blå, så det er muligt at se tryptophan- og lysin-monomererne der binder strukturen sammen.
Dannelsen af kvaternære strukturer er af stor vigtighed for aktiveringen og deaktiveringen af proteiner. Mange toksiner som bigift og slangegift bruger denne fremgangsmåde for at forhindre at dyret dør af sin egen gift. Ved denne type gift, har proteinet en skal-lignende struktur, med det aktive site i hulningen. På kanten af skallen, er der nogle hydrofobe monomerer, hvilket muliggør hydrofobe interaktioner. I giftsækken, hvor koncentrationen af gift er høj, aggregerer molekylerne og danner dimerer eller trimerer, afhængig af giften, med den hule side pegende indad mod midten, således at det aktive site afskærmes fra substratet og giften derved inaktiveres. Ved lave koncentrationer, f.eks. slangegiften der kommer ind i byttedyrets blodbane, falder aggregeringen fra hinanden, og det aktive site bliver blotlagt og giften er aktiv.

Krystalstruktur af giften fra den indiske cobra (Naja naja naja) i dens kvartenære form. De individuelle giftmolekyler er farvet rød, grøn og blå, så det er muligt at se tryptophan- og lysin-monomererne der binder strukturen sammen.