
Kompleksdannelser
Reaktionstyper
Hvad er kompleksdannelser?
Kompleksdannelser er en elektrostatisk effekt, dvs. forskellen i ladningsfordelinger der giver tiltrækning eller frastødning. Orienteringen af enhederne i komplekset er lige så låste som dem man ser ved kovalente og ioniske bindinger. Dette kaldes koordinering og enhederne der er koordinerede kaldes ligander. Ved komplekser er der ikke en formel deling af elektroner, som man ser ved kovalente bindinger. I virkeligheden er det ikke helt korrekt, idet der vil være en naturlig udveksling af elektroner, men som model til beskrivelse og til at regne på kompleksdannelser, er det en god tilnærmelse.
Hvordan ser de ud?
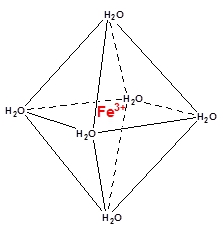 Rundt om små simple ioner er der sædvanligvis seks tilgængelige positioner for komplekser som f.eks. det grønne jern(III)hexahydrat-kompleks (se struktur til højre), men de bliver ikke nødvendigvis brugt alle sammen. Pladserne bliver fyldt ud, sædvanligvis af solventet, hvis det er en opløsning, men det der er på positionen er ikke koordineret. De seks pladser forudsætter også, at der er plads. Liganderne kan let blive så store, at der kommer steriske hindringer, dvs. ligandernes fylder så meget, at de er i vejen for hinanden. F.eks. ved komplekset CuCl42− sidder de fire Cl− i en tetraedrisk formation, som en effekt af elektrostatikken (deres frastødning af hinanden) og størrelsen på Cl−.
Rundt om små simple ioner er der sædvanligvis seks tilgængelige positioner for komplekser som f.eks. det grønne jern(III)hexahydrat-kompleks (se struktur til højre), men de bliver ikke nødvendigvis brugt alle sammen. Pladserne bliver fyldt ud, sædvanligvis af solventet, hvis det er en opløsning, men det der er på positionen er ikke koordineret. De seks pladser forudsætter også, at der er plads. Liganderne kan let blive så store, at der kommer steriske hindringer, dvs. ligandernes fylder så meget, at de er i vejen for hinanden. F.eks. ved komplekset CuCl42− sidder de fire Cl− i en tetraedrisk formation, som en effekt af elektrostatikken (deres frastødning af hinanden) og størrelsen på Cl−.Selv om komplekser indeholder et solvent, behøver de ikke at være i opløsning. Krystalvand er et almindeligt fænomen i uorganiske forbindelser. Kobber(II)sulfat, CuSO4 er et hvidt salt, uden krystalvand, og et blåt salt som pentahydratet, CuSO4 · 5 H2O.
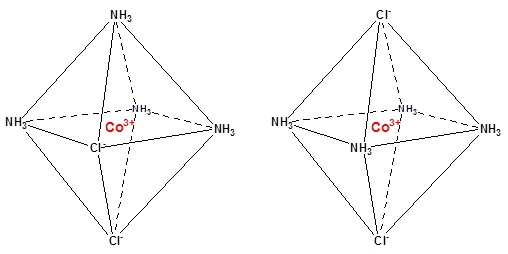
Der kan være geometriske isomerer i komplekserne. Kobolt(III)chlorid/ammoniak-komplekset, CoCl3(NH3)4, kan optræde som to isomerer, med forskellige farver. Af de tre chlorid, er to af dem låst fast i komplekset. Her kan de sidde cis eller trans, dvs. ved siden af hinanden eller på hver sin side af Co3+ (se nedenstående strukturer). Trans-komplekset er grønt og cis-komplekset er lilla.
Større komplekser som iod/stivelse, som bruges til iodometriske titreringer, kræver strukturopklaring, som man kender det fra 2D NMR eller røntgenskrystallografi.
Reaktionsskemaer
Som reaktioner betragtet, er kompleksdannelser ikke forskellige fra fældninger eller ligevægte, når det kommer til afstemning og beregninger, f.eks.
Sølvioner og ammoniak der danner sølvdiamin-komplekser:
Ag+(aq) + 2 NH3(aq) [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)
Kobber(II)-ioner der danner grønne komplekser med cyanid-ioner:
Cu2+(aq) + 4 CN−(aq) [Cu(CN)4]2−(aq)
[Cu(CN)4]2−(aq)
Sølvioner og ammoniak der danner sølvdiamin-komplekser:
Ag+(aq) + 2 NH3(aq)
 [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)Kobber(II)-ioner der danner grønne komplekser med cyanid-ioner:
Cu2+(aq) + 4 CN−(aq)
 [Cu(CN)4]2−(aq)
[Cu(CN)4]2−(aq)