
Resonansstrukturer
Reaktionstyper
Hvad er resonansstrukturer?
Normalt tænker vi på bindinger som lokaliserede eller statiske strukturer, og i de fleste tilfælde opfører de de sig som om de er. I det mindste til beskrivelser. I kemi i praksis og ved avancerede beskrivelser, er resonansstrukturer noget der hjælpe en langt til forståelsen af kemiske reaktioner, eller manglen på samme.
Det klassiske eksempel på resonansstrukturer er benzenringen. Benzen er en ring af 6 carbonatomer med konjugerede dobbeltbindinger (dvs. alternerende enkelt- og dobbeltbindinger). Når man tegner ringen, skal dobbeltbindingerne være lokaliseret i 2 forskellige positioner, som vist på fig. 1. Begge er lige rigtige og forkerte. Dobbeltbindingen mellem position 1 og 2 er der noget af tiden, men i gennemsnit er der i virkeligheden 1,5 bindinger mellem alle carbonatomer. Bindingen siges at være delokaliseret, hvilket er årsagen til, at benzenringen ofte skrives som en hexagonal med en cirkel.
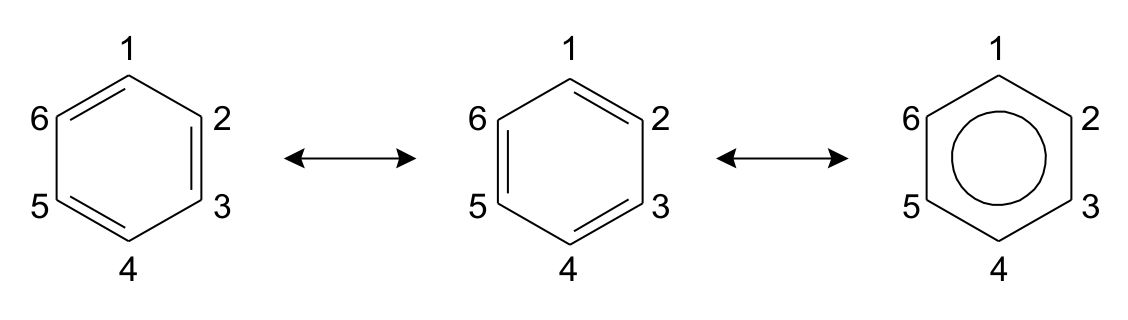
Fig. 1: Resonansstrukturer i benzen.
Forskellen ved omarrangeringen af elektronerne kaldes resonansstrukturer og forskellen mellem strukturerne vises med en enkelt pil, der peger i begge retninger.
Det klassiske eksempel på resonansstrukturer er benzenringen. Benzen er en ring af 6 carbonatomer med konjugerede dobbeltbindinger (dvs. alternerende enkelt- og dobbeltbindinger). Når man tegner ringen, skal dobbeltbindingerne være lokaliseret i 2 forskellige positioner, som vist på fig. 1. Begge er lige rigtige og forkerte. Dobbeltbindingen mellem position 1 og 2 er der noget af tiden, men i gennemsnit er der i virkeligheden 1,5 bindinger mellem alle carbonatomer. Bindingen siges at være delokaliseret, hvilket er årsagen til, at benzenringen ofte skrives som en hexagonal med en cirkel.

Fig. 1: Resonansstrukturer i benzen.
Forskellen ved omarrangeringen af elektronerne kaldes resonansstrukturer og forskellen mellem strukturerne vises med en enkelt pil, der peger i begge retninger.
Hvad er den praktisk betydning af resonansstrukturer?
Resonansstrukturer er vigtige, da de forklarer adskillege effekter i organisk syntese, såsom hvorfor benzenringens struktur er så stabil som den er, og hvorfor visse substitutioner, som amin på benzen, styrer ortho og para (positionerne 2, 4, og 6) mens andre, som nitrogruppen, dirigerer meta (positionerne 3 og 5) i elektrofil aromatisk substitution.
Specielt er keton/enol-isomerer vigtige (fig. 2), da stabiliteten af isomererne påvirker effektiviteten af reaktionen i diverse additions- og eliminationsreaktioner.
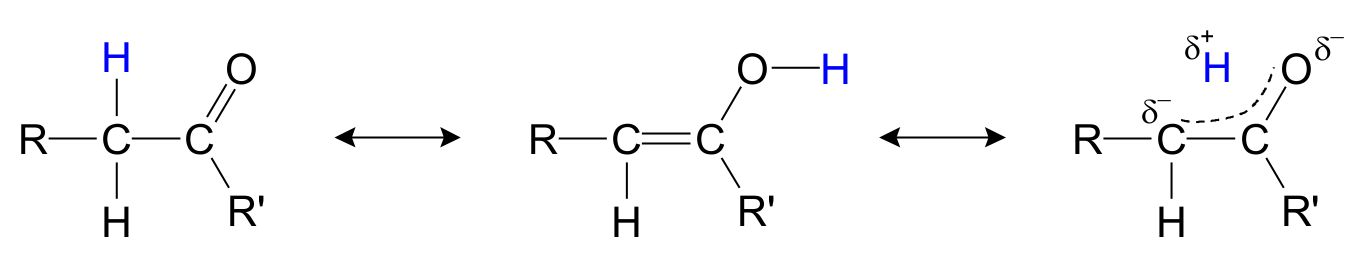
Fig. 2: Resonansstrukturer for keton/enol.
Som det ses, kan hydrogenet, markeret med blåt, findes ved siden af carbonylgruppen, hvilket er den traditionelle måde at lave en 2D tegning af en keton. Men hydrogenet kan også flytte sig over til oxygenet, og derved fremtvinge dannelsen af en alkoholgruppe og en C-C dobbeltbinding. Den faktiske struktur er for det meste et sted midt i mellem, med hydrogenet der flyder mellem carbon og oxygen og dobbeltbindingen er spredt ud på C-C og C-O bindingerne.
Specielt er keton/enol-isomerer vigtige (fig. 2), da stabiliteten af isomererne påvirker effektiviteten af reaktionen i diverse additions- og eliminationsreaktioner.

Fig. 2: Resonansstrukturer for keton/enol.
Som det ses, kan hydrogenet, markeret med blåt, findes ved siden af carbonylgruppen, hvilket er den traditionelle måde at lave en 2D tegning af en keton. Men hydrogenet kan også flytte sig over til oxygenet, og derved fremtvinge dannelsen af en alkoholgruppe og en C-C dobbeltbinding. Den faktiske struktur er for det meste et sted midt i mellem, med hydrogenet der flyder mellem carbon og oxygen og dobbeltbindingen er spredt ud på C-C og C-O bindingerne.